已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
| 元素 |
性质或结构信息 |
| A |
单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。 |
| B |
原子的M层有1个未成对的p电子。核外p电子总数大于7。 |
| C |
单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。 |
| D |
原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。 |
| E |
其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。 |
| F |
周期表中电负性最大的元素 |
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
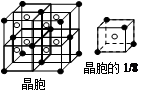
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。
I .含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II.从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III.已知乙烯能发生以下转化:
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
(2小题每空3分,1、3小题每空2分,共16分)已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛: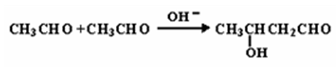
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的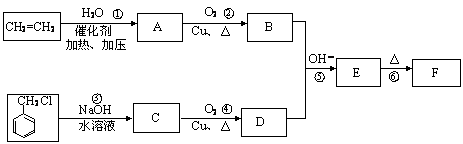
已知:反应⑥为含羟基的物质在浓硫酸催化作用下分子内脱水的反应。反应⑤为碱性条件下醛醛加成反应,请回答
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)写出下列转化的化学方程式:
②_________________。
③ 。
写出有关反应的类型:① ,④ 。
(3)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
(1~4小题每空2分,5~6小题每空3分,共14分)A~G是几种烃的分子球棍模型(如图),据此回答下列问题: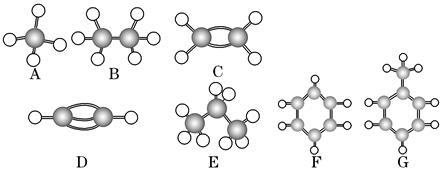
(1)常温下含碳量最高的气态烃是________(填字母)。
(2)不能够发生加成的烃有________种。
(3)一卤代物有两种的是________(填字母)。
(4)等质量的上述烃燃烧耗氧最多的是 (填字母)。
(5)写出实验室制C的化学方程式_______________。
(6)写出F发生溴代反应的化学方程式________ ____。
(1~5小题每空2分,6小题3分,共17分)
以下是实验室常用的部分仪器,请回答下列问题
(1)序号为⑥和⑩的仪器的名称分别为________、________。
(2)在过滤操作中,必须用到上述仪器中的___(填序号),次外,上图中还缺少的玻璃仪器 (填名称)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)仪器上标有温度的是_______(填序号)。
(5)如图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是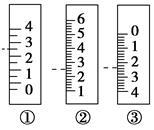
| A.①是量筒,读数为2.5 mL |
| B.②是量筒,读数为2.5 mL |
| C.③是滴定管,读数为2.5 mL |
| D.②是温度计,读数是2.5 ℃ |
(6)丙同学想用如图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。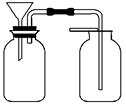
按要求填空。
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是__ ______。
(2)已知拆开1 mol H—H键、1 mol I—I分别需要吸收的能量为436 kJ、151 kJ,而形成1 mol H—I键会释放299 kJ能量。则由氢气和碘反应生成1 mol HI需要________(填“放出”或“吸收”)_______ __kJ的热量。
(3)S(g)+O2(g)=SO2(g) ΔH 1<0;S(s)+O2(g)=SO2(g) ΔH 2<0,比较ΔH1 __ ___ΔH2大小。