已知制取氯气也可用浓盐酸与高锰酸钾为原料,其化学方程式为
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。请回答下列问题:
(1)用双线桥法标出该化学式电子转移的方向与数目:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)反应中被还原的元素为 (写名称);标准状况下当生成112 L氯气时,反应中转移的电子数目为 。
(3)若有4 molHCl被氧化,则可生成标准状况下的氯气 L。
(4)若有1.58g高锰酸钾和100mL10moL/L浓盐酸充分反应(不考虑盐酸挥发,忽略溶液体积的前后变化),反应至终点时高锰酸钾紫色完全褪去,则被氧化的HCl的物质的量
为 mol。将反应后的溶液取出10mL,加入足量的硝酸银溶液,可得到沉淀的物质的量为 mol。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3SO4的致密的保护层——“发蓝”。主要反应如①②③:
①3Fe+NaNO2+5NaOH→3NaFeO2+NH3+H2O
②___Na2FeO2+____NaNO2+____H2O→Na2Fe2O4+NH3+NaOH
③Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②,标出电子转移方向和数目。
(2)上述反应②中还原剂为,被还原物质是____。
若有1mol Na2Fe2O4生成,则反应中有____mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:。
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的原子最外层共有种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置。
(2)糖类是人体获得能量的来源之一。已知1mol葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式____。
(3)CO2是一种温室气体,它的电子式为,将其转变其他化工原料,必须破坏的化学键属于____.(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+'>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系。
(15分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)
 (1)①A物质的名称为:______。(2分) ②X E+K的反应类型是______。(2分)
(1)①A物质的名称为:______。(2分) ②X E+K的反应类型是______。(2分)
(2)G、F中所含的含氧官能团的名称分别为___________、___________。(各1分)
(3)E与H反应的化学方程式是________________________________;(2分)
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,
B→I的化学方程式________________________________________;(2分)
(5)已知J有多种同分异构体,符合下列性质的J的同分异构体共有_____种。(3分)
①与FeCl3溶液作用显紫色; ②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种。写出其中一种一氯代物的结构简式____________(2分)
请回答
(1)若甲、乙、X均是化合物,Y是单质,则Y可能是。(填化学式,下同)
(2)若酸性X>Y,且甲过量,Y是白色浑浊,则Y是乙是(各1分)
(3)若甲、乙是金属单质,X为固体,则反应的化学方程式是
(4)甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y是化合物。X溶液呈淡绿色,Y的溶液能使KSCN溶液变红。
①将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体丙,证明丙的操作、现象及结论
是(3分)
②单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为:(用化学式表示)
③当X与甲1:1充分反应的离子方程式:(2分)
[化学——-选修5:有机化学基础]有机物A为芳香烃类化合物,质谱分析表明其相对分子质量为104,分子中含有碳碳双键,F为有香味的有机化合物,G是一种能制成塑料的高分子化合物,其相关反应如下图所示: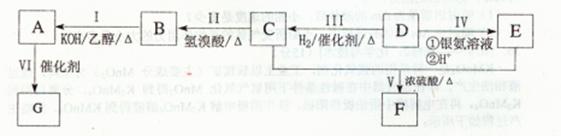
(1)D中所含官能团为_______。
(2)II的反应类型为 _______,G的结构简式为_______。
(3)写出下列反应的化学方程式: I:_______;V;_______。
(4)若A分子中的一个H原子在一定条件下被Cl原子取代,互为顺反异构体,它们的结构简式为_______。
(5)E有多种同分异构体,其中含有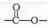 结构,且苯环上含有两个取代基的有____种,其中在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:_______
结构,且苯环上含有两个取代基的有____种,其中在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:_______