如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题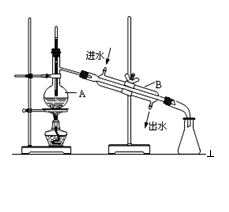
(1)图中明显的两处错误是
①_________________________________________
②_________________________________________
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入自来水外,还需加入少量__________,其作用是________________。
某课外活动小组欲利用CuO与 反应,研究
反应,研究 的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为;仪器b中可选择的试剂为。
(2)实验室中,利用装置A,还可制取的无色气体是(填字母)
A. |
B. |
C. |
D. |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明 具有性,写出相应的化学方程式
具有性,写出相应的化学方程式
。
(4)E装置中浓硫酸的作用
。
(5)读取气体体积前,应对装置F进行的操作:
。
(6)实验完毕,若测得干燥管D增重 ,装置F测得气体的体积为
,装置F测得气体的体积为 L(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含
L(已折算成标准状况),则氨分子中氮、氢的原子个数比为(用含 、
、 字母的代数式表示)。
字母的代数式表示)。
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如右图: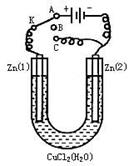
(1)如果把电键K接A,这一装置形成_________装置,Zn①极是________极,其电极反应式是_________;
Zn②极上的电极反应式是____________________。
(2)上述反应进行5min后,转换电键K到C,这一装置形成____________装置,Zn①极是__________极,该装置发生反应的总化学方程式是___________________________;
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。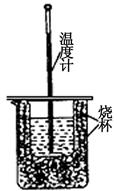
①从实验装置上看,图中尚缺少的一种玻璃仪器是。
②大小烧杯之间填满纸屑的作用是。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值(填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下: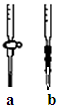
①应选择滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 |
起始滴定管读数 |
终点滴定管读数 |
| 1 |
0.00mL |
24.04mL |
| 2 |
0.50mL |
24.46mL |
| 3 |
2.50mL |
25.02mL |
测得未知稀盐酸的物质的量浓度为(保留小数点后3位)。
⑤以下操作造成测定结果偏高的原因可能是(填写字母序号)。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔气体中还可能混有少量具有还原性的杂质气体,由此他提出必须先除去杂质气体,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式:________________。
(2)甲同学设计的实验______________(填“能”或“不能”)验证乙炔与溴发生了加成反应,其理由是__________________。
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔
(3)乙同学推测生成的乙炔气体中必定含有的一种杂质气体是________,它与溴水反应的化学方程式是__________________,在做验证实验前必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框内,并写出装置内所盛化学药品的名称。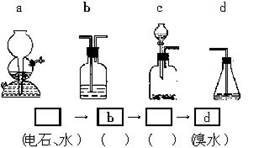
(5)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后溶液的酸碱性,由此来判断反应类型,理由是___________________。
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(+2价):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
⑴ 可用上图中装置(填编号,多选)进行氨气的实验室制备。
D装置可用于下列(填编号,多选)气体的制备。
a CO2 b O2 c SO2d C2H4 e C2H2 f H2
⑵ 装置③、④若用同一装置,则该装置中所盛装的药品是(填编号)
| A.氯化钙 | B.浓硫酸 | C.五氧化二磷 | D.碱石灰 |
⑶ 装置⑥中,粗玻璃管X的作用,装置⑦的作用
⑷ 装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸ 当进入装置⑤的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则NO的转化率为。