按要求填空
(1)a、e属于短周期的同族元素,a的原子半径最小,e的原子半径最大(稀有气体除外),写出它们组成化合物的化学式__________,其化学键的类型是 。
(2)C、N、O的第一电离能由大到小的顺序为 。NH3·H2O的电离方程式为 NH3·H2O NH4++OH-,试判断溶于水后,形成的合理结构是______。(填图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是______。(填图中的字母)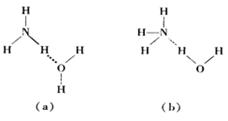
AsH3空间形状为______________;(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为__________;CaC2中C22―、N2与O22+互为等电子体,O22+的电子式可表示为 。
化学与生活、社会密切相关。下列说法正确的是
| A.红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 |
| B.氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C.NO可用于某些疾病的治疗;SO2可用于食品防腐剂 |
| D.明矾可用于水的消毒、杀菌;硫酸钡可用于钡餐透视 |
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
| A.该试剂的物质的量浓度为9.2 mol/L |
| B.该硫酸50 mL若用5 mol/L的氢氧化钠中和,需要该氢氧化钠溶液100毫升 |
C.该硫酸与等体积的水混合所得溶液的质量分 数等于49% 数等于49% |
| D.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL |
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A. mol/L mol/L |
B. mol/L mol/L |
C.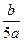 mol/L mol/L |
D. mol/L mol/L |
下列说法中正确的是
| A.全部由非金属元素组成的化合物中可能含有离子键 |
| B.所有的单质中都含有化学键 |
| C.只要化学键断裂了,一定有化学反应发生 |
| D.分子是保持物质化学性质的一种微粒,且是化学变化中最小的微粒 |
下列叙述错误的是
| A.1mol任何物质都含有约6.02×1023个原子 |
| B.12g12C含有约6.02×1023个碳原子 |
| C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 |
| D.物质的量是国际单位制中七个基本物理量之一 |