把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g)=2CO2(g) △H3<0 ③
2H2(g)+O2 (g)=2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量,原因是 。
(2)△H1、△H2、△H3、△H4的数学关系式是 。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为 。
(4)煤炭作为燃料采用途径II的优点有
2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图
试回答下列问题:
(1)800℃时。0—5min内,以B表示的平均反应速率为。
(2)能判断该反应达到化学平衡状态的标志是。
A.容器压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
E. 混合气体的平均分子量不再改变 F. 混合气体密度不变
G. A:B:C:D= 1:2:1:1
(3)利用图中数据计算800℃时的平衡常数K=,B的平衡转化率为:。该反应为反应(填吸热或放热)。
(4)800℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:
n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应
进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)AgNO3的水溶液呈(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的中,然后再用蒸馏水稀释到所需的浓度。若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32—水解所至。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:
负极:
正极:;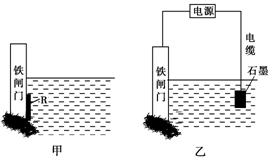
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________。
| A.铜 | B.钠 | C.锌 | D.石墨 |
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2ml&url=http://static3.photo.sina.com.cn/orignal/515359c4g79a1c1001942&690
http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2ml&url=http://static3.photo.sina.com.cn/orignal/515359c4g79a1c1001942&690
①氢氧燃料电池的能量转化主要形式是,在导线中电子流动方向为(用a、b表示)。
②负极反应式为。
③电极表面镀铂粉的原因为。
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l); H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g) ; H="-242" kJ·mol-1
H="-242" kJ·mol-1
③ C(s)+1/2O2(g)="CO(g)" ; H= —110.5 kJ·mol-1
H= —110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g); H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g); H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO (g) H="a" kJ·mol-1;则a=;该反应的熵
H="a" kJ·mol-1;则a=;该反应的熵 S0(选填“>”、“=”、“<”)。
S0(选填“>”、“=”、“<”)。
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6 NOx (2x + 3)N2 + 6xH2O
(2x + 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
①装置A中发生反应的化学方程式为 ▲。
②装置C的作用是 ▲。
③装置F的作用是 ▲。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2(I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2(II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲(填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:
图中线段a表示 ▲离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲。
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol-1,且其中各元素的质量比为:
钾 : 金属B : 氧=39 : 28 : 32。
请回答下列问题: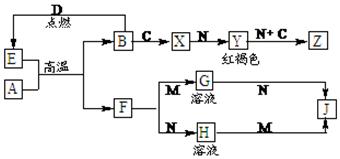
(1)Z的化学式为: ▲ 。
(2)写出检验X中阳离子的方法: ▲ 。
(3)写出E和A在高温下反应的化学方程式为: ▲ 。
(4)写出A和N反应的离子方程式: ▲ 。