某工厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红(Fe2O3)和氧化铜。(已知铜能溶解在稀硝酸中生成硝酸铜溶液)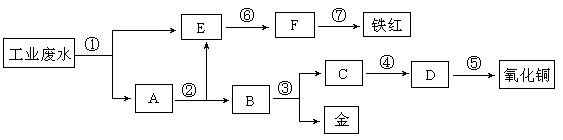
请填写下面空白:
(1)图中标号处需加入的相应物质分别是(填化学式)① ②
③ ④ ;
(2)A处固体成分为 (填化学式)
(3)写出⑤处反应的化学方程式 ;
下图是某儿童微量元素体检报告单的部分数据: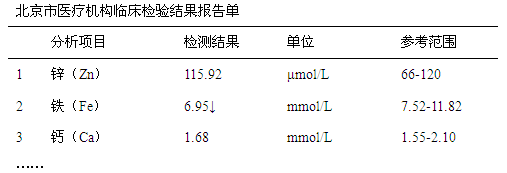
根据上表的数据,回答下列问题:
(1)该儿童 元素含量偏低。
(2)报告单中“μmol/L”是 (填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的 (填“氧化性”或“还原性”)。
(4)缺铁性贫血患者应补充Fe2+。一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的作用是 。
有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
从铝土矿(主要成分是Al2O3,含Fe2O3、MgO和一些不溶于酸碱的杂质)中提取氧化铝两种工艺流程如下:
请回答下列问题:
(1)写出步骤②中加入烧碱后的离子方程式为_________________ _____________。
(2)列举氧化铝的两种常见的用途____ ______、________ __________。
(3)沉淀C的主要成分是______________ ______________(填化学式)。滤液D与少量CO2反应的离子方程式为___________ ________________。
(4)步骤③、④中不能用硫酸代替CO2,原因是__________________ _____________。向该滤液M中加入少量澄清石灰水的离子方程式为____________ ______________。
(5)沉淀F在过滤后需要洗涤,请写出检验F是否洗涤干净的方法_________ ________。
(6)若现在有10t的铝土矿,其中铝元素的质量分数为10.8%,则在流程乙中溶解时,需要4mol/L的NaOH溶液至少_____ __L。
仔细观察下图,根据题意对图中两极进行必要的连接后填空:
(1)若在图A中,使铜片上冒H2气泡。则加以必要的连接后的装置叫 。
(2)若在图B中,a、b为惰性电极,进行必要的连接后使b极析出1.28g铜,则a极析出的物质的物质的量为 ,反应的总反应方程式为 。
(3)若将图A中Zn、Cu两极与图B中a、b作必要的边接后,也能产生与(1)、(2)完全相同的现象,则Cu极连_______极(填a或b)。经过一段时间后,停止反应并搅匀溶液,图B中溶液的pH_________(填写“升高”、“降低”或“不变”),欲使溶液恢复至与反应前完全一致,则应加入的一定量的物质是_________。
| A.CuO | B.Cu(OH)2 | C.Cu2(OH)2CO3 | D.CuCO3 |
室温下,某同学将某一元酸HX和NaOH溶液等体积混合,测得两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HX物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
c2 |
c2 |
pH=10 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若HX为强酸,则a 7(填“>”“<”或“=”);若HX为弱酸,则a 7(填“>”“<”或“=”)。
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L。