研究物质间的氧化还原反应有重要的意义。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42−+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42−
电解池中阴极反应式____________。
A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图: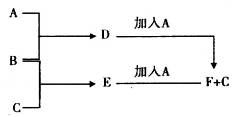
填写下列空白:
(1)物质A是____________,物质B是___________,B元素的离子结构示意图为___________。
(2)写出化合物E的电子式:____________,D的饱和溶液滴入沸水中溶液呈红褐色的原因是(用离子方程式表示):_______________________________,D溶液可以用来止血。
(3)工业上把B单质与石灰乳反应可制得漂白粉,漂白粉的有效成份是_______,漂白粉常用于自来水的杀菌消毒,原因是:(用化学方程式和适当的文字说明)______________________。
(4)F中加入NaOH溶液,并在空气中放置,沉淀由白色变为灰绿色最后变成红褐色的化学方程式是_____________________________________。
I.已知:反应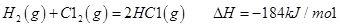
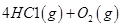
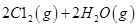
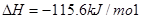
请回答: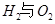 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: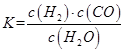
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应
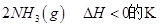 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应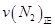 ____________
____________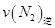 (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应: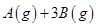
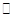
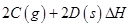 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:
请完成下列问题:
①判断该反应的 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A.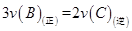 B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
一种用于治疗高血脂的新药——灭脂灵H可按如下路线合成: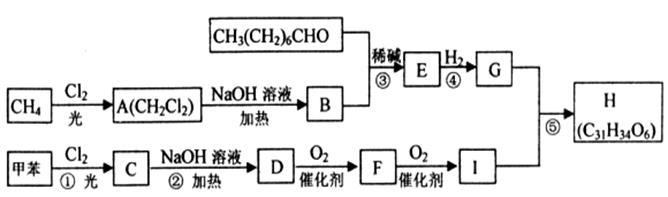
已知①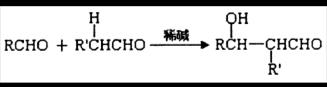
②一个碳原子上同时连接两个羟基,立即失去一分子水,生成另一种物质,如: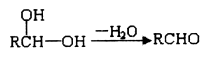
③G的分子式为C10H22O3
请回答:
(1)写出B、E的结构简式:B____________,E____________。
(2)G含有的官能团的名称是________________________。
(3)反应①~⑤中属于取代反应的有________________________(用编号表示)。
(4)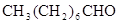 有多种同分异构体,符合下列性质的结构简式是:
有多种同分异构体,符合下列性质的结构简式是:
____________________________________(写一种)。
A.能发生银镜反应 B.烃基上的一氯取代物只有两种
(5)写出下列反应的化学方程式:
反应②的化学方程式为____________________________________。
D→F的化学方程式为____________________________________。
反应⑤的化学方程式为____________________________________。
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: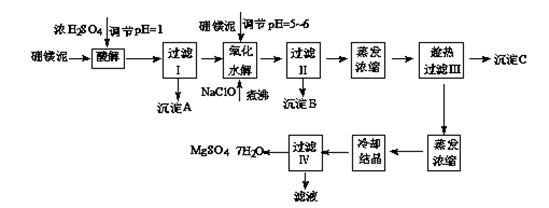
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为。加热煮沸的主要目的是。
(2)沉淀B中除MnO2、SiO2外还含有(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是;
(4)沉淀C的化学式是。过滤III需趁热过滤的理由是