海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下: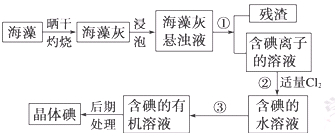
(1)指出操作③的名称: ;操作②中充入适量Cl2的目的是 。
(2)提取碘的过程中,可供选择的试剂是 ( )
| A.酒精 | B.四氯化碳 | C.汽油 | D.醋酸 |
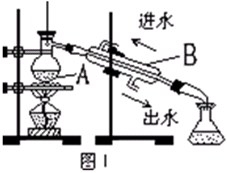
(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏。图I是某同学设计的蒸馏装置,图中明显的错误是 。
(4)有同学认为蒸馏时最好使用水浴加热,使用水浴的优点是: ;蒸馏结束,晶体碘聚集在 (填仪器名称)里。
(5) 实验③分离出来的废液中含有Cl–、SO42–,现只取一次试液,如何鉴别出Cl–、SO42–,依次加入试剂的为: 、 。
(6)某小组同学实验时需用到一定物质的量浓度的碘水溶液225mL,配制时需要的仪器除天平、玻璃棒、烧杯外,还需 、 。若摇匀时,发现液面低于刻度线,则配得溶液浓度(填偏大、偏小或无影响)。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是445.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ处连接的装置分别是_______________
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是。
(3)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式。
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为%(用含a、b的代数式填写)
(5)若去掉尾端球形干燥管则会导致测量结果(偏低或偏高)。
下图为从反面看到的某套实验装置示意图,无法看到实验说明,加热装置已经省略。
甲同学认为此套装置用于合成物质X,E处冰水冷却的U型管中有固体X(X溶于水得到中学化学常见强酸)出现;乙同学认为此套装置用于合成物质Y,E处冰水冷却的U型管中才有红棕色气体Y生成,并且越接近U型管底部颜色越浅。对于A处,甲认为有加热装置,乙认为没有。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是,C装置中盛放的液体药品是。其作用是_______________________________。
(2)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时所起作用相似,那么C处的广口瓶应改为,所装药品为。
(3)写出乙同学认为的D装置中发生反应的化学方程式。为什么此时U型管中的红棕色气体越接近管底颜色越浅?__________________________________。
芳香族有机物A(C11H12O2)可用作果味香精。用含碳、氢、氧三种元素的有机物B和C为原料可合成A。请按所给信息及相关要求填空:
(1)有机物B的蒸气密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3。有机物B的分子式为。
(2)有机物C的分子式为C7H8O,C能与钠反应,不与碱反应,也不能使溴的四氯化碳溶液褪色。C的名称为。
(3)已知两个醛分子间能发生如下反应(﹣R、﹣R′表示氢原子或烃基):
用B和C为原料按如下路线合成A: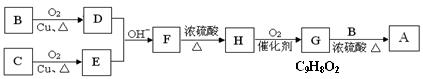
①上述合成过程中涉及的反应类型有:(填写序号)
a.取代反应 b. 加成反应 c. 消去反应 d. 氧化反应 e. 还原反应
② F的结构简式为:。
③G和B反应生成A的化学方程式:。
(4)F的同分异构体有 多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式。
多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式。
A、B、C、D、E、F、X七种物质之间可按下列框图发生反应(部分产物可能被省略)。其中,A、D、E、X是四种常见的非金属单质,常温下A、X为气体,D、E为固体。A的水溶液具有漂白性,A、D的水溶液均能使淀粉KI试纸变蓝色,B的焰色反应为黄色。请回答下列问题:
(1)写出A、F的化学式:A:、F:。
(2)写出B的电子式:,EO2的晶体类型为。
(3)写出E与NaOH溶液反应的离子方程式。
(4)E单质可作高能燃料。已知ag固体E燃烧放出bkJ的热量,请写出表示E燃烧热的热化学方程式(△H用含a、b的式子表示)。
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是g。
(2)镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的稀硫酸),电池总反应为:Mg+H2O2+H2SO4= MgSO4 +2H2O。该电池工作时,正极发生的电极反应式为:。此时,正极周围海水的pH:(填:增大、减小或不变)
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O
 Al(OH)4-+ H+②NH3+H2O
Al(OH)4-+ H+②NH3+H2O NH4+ + OH-
NH4+ + OH-
(A)已知B(OH)3是一元弱酸,试写出其电离方程式。
(B)已知N2H4是二元弱碱,试写出其第二步电离方程式。