温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。试根据图中数据,填写下列空白: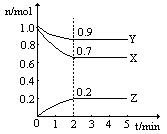
(1)从开始至2min,Z的平均反应速率为 。
(2)该反应的化学方程式为 。
(3)保持温度和体积不变,若n(X)=2mol,n(Y)="3" mol,n (Z)=1mol,该反应向 (填“正反应”或“逆反应”) 方向进行。
(共10分)以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。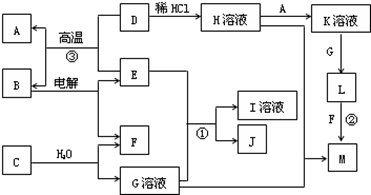
(1)B的化学式______;
(2)19.5gC与足量的水反应转移电子的物质的量为______mol;
(3)写出物质C的电子式;
(4)写出②、③反应的离子方程式②,③。
(共6分)一定温度下,在一定容积的密闭容器中发生如下可逆反应:
2A(g)+B(g) 2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题:
2C(g) ,在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。试回答下列问题: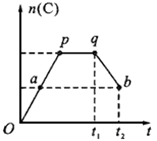
(1)a点时,反应的v(正)v(逆)(填“>”、“<”或“=”);
(2)此反应的逆反应为热反应(填“放”或“吸”);
(3)a、b两点的正反应速率:v(a)v(b)
(填“>”、“<”或“=”)。
(共4分)在一个固定体积为2升的密闭容器中,充入2molA和1molB, 发 生如下反应:2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2mol/L。
(1)2分钟内用B表示的平均反应速度为;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为:(填“吸热”或“放热”)反应。
铁与HNO3作用时,还原产物除与HNO3浓度有关外,还与温度有关。已知铁
与冷的稀HNO3反应时,主要还原产物为NO气体;与热的稀HN03反应时,主要还原产物
为N2O气体;当HNO3更稀时,其重要还原产物是NH4+。现有铁与稀 HNO3的作用,请分析
下图,回答有关问题。
假设曲线的各段内只有一种还原产物。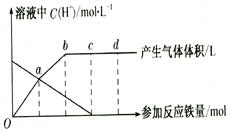
(1)0点到a点的还原产物是 ________ __。
(2)a点到b点的还原产物是____,其原因是 。
(3)试完成b点到c点的反应方程式:
口Fe+口HNO3——口Fe( NO3)3+口[ ]+口H20。
(4)反应过程中,到达 ________ 点时,HN03已完全反应。
(5)已知达到d点时反应结束,此时溶液中的主要阳离子是 。
(6)c点和d点参加反应的铁的物质的量之比是 ___________。
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为: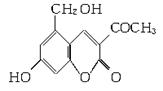
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式。