实验室里迅速制备少量氯气可利用以下反应:
KMnO4+ HCl  KCl + MnCl2 + Cl2↑ + H2O
KCl + MnCl2 + Cl2↑ + H2O
(1)请配平上述化学方程式,并在上面用“双线桥法” 标明电子转移的方向和数目:
(2)该反应的氧化产物是 ,KMnO4发生 反应。
(3)HCl在上述反应中显示出来的性质是 。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(4)用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为 mol,需要KMnO4的质量 g,转移电子数为 。
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0)
N2O4(g) ΔH=-a kJ·mol-1 (a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
①298k时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是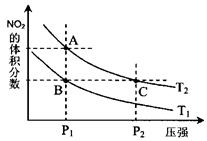
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,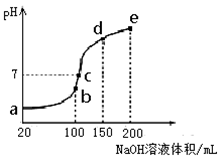
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是;
③在c点,溶液中各离子浓度由大到小的排列顺序是_______。
(16分)碳酸二甲酯(简称DMC)是一个绿色化学品,可取代光气等有毒物质作为羰基化或甲基化试剂,如:
合成DMC的一种方法如下:
(1)化合物II核磁共振氢谱有组峰;1mol该物质可以跟molH2发生加成反应。
(2)反应①中副产物甲醇发生催化氧化反应的方程式为。
(3)反应②原子利用率100%,则化合物III的名称是。化合物IV的结构简式是。
(4)化合物V是化合物II的一种同分异构体,其苯环上的一氯代物有两种,且能发生水解反应和银镜反应,则化合物V的结构简式为(写其中一种)。
(5)一定条件下,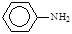 与DMC 1:1发生类似反应①的反应,请写出反应方程式。
与DMC 1:1发生类似反应①的反应,请写出反应方程式。
某同学设计由G(CH3CH2OH)合成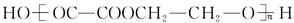 的合成路线如下:[( )内为反应类型,
的合成路线如下:[( )内为反应类型, 内为目标产物]
内为目标产物]
①写出反应类型:a________,b________;
②写出 内物质的结构简式:Ⅰ______________,Ⅱ______________。
内物质的结构简式:Ⅰ______________,Ⅱ______________。
③写出Ⅱ→Ⅲ的化学反应方程式。
④Ⅲ与Ⅵ反应合成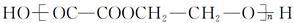 的化学方程式。
的化学方程式。
从中草药茵陈蒿中可提取出一种利胆有效成分——对羟基苯乙酮,其结构简式为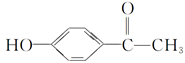 ,这是一种值得进一步研究应用的药物。
,这是一种值得进一步研究应用的药物。
(1)推测该药物不具有的化学性质是______。
| A.能跟氢氧化钾反应 |
| B.能跟浓溴水反应 |
| C.能跟碳酸氢钠反应 |
| D.在催化剂存在时能被还原成含醇羟基的物质 |
(2)写出上述(1)中能发生反应的所有化学方程式:。
分子的性质是由分子的结构决定的,通过对下列分子结构的观察来推测它的性质:
(1)此有机物中含有的官能团(填名称)
(2)苯基部分可发生________反应和__________反应(填反应类型)。
(3)—CH===CH2部分可发生__________反应和_______反应等,检验此官能团所用试剂为。
(4)写出此有机物形成的高分子化合物的结构简式:______________。
(5)试判断此有机物的—C(CH2Cl)3部分______(填“能”或“不能”)发生消去反应。