人教版新课标化学教材九年级上册(2012教育部审定)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 |
实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 |
A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 |
试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
|
【实验结论】
(1)A中产生的气体是 ;
(2)实验II、III证明:氧化铁的质量和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的化学方程式 。
【实验评价】
实验设计IV的目的是 ;
若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验拓展】
查阅资料得知,CuO、CuSO4、、、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是 。
A.MnO2只能作过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.酶是一种重要的生物催化剂,它属于糖类
E.用作催化剂的物质不可能是其他反应的反应物或生成物
用集气瓶可完成多种实验。请根据如下实验装置示意图,回答有关问题: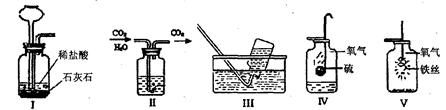
(1)实验装置I中进行的化学反应的化学方程式是。
(2)要达到装置图II所示实验的目的,集气瓶中装入的试剂是。
| A.浓盐酸 | B.浓硫酸 |
| C.生石灰 | D.碱石灰(氢氧化钠与氧化钙的混合物) |
(3)用实验装置Ⅲ收集气体时,若要收集尽可能多的气体,在不更换集气瓶的前提下,你的做法是。
(4)实验装置Ⅳ的集气瓶中预先加入了少量水,其作用是,还可以将水换成。
(5)通过Ⅳ、V两个实验,结合课堂学习,你认为在“集气瓶中进行燃烧的实验”应该注意的问题是(说出两点即可)①,②。
某校化学兴趣小组欲对食盐的用途进行探究,获得以下信息并对相关问题进行研究。
一、用途之一:作调味品。
食盐的主要成份是NaCl,通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 |
||
| OH- |
CO32- |
|
| Na+ |
溶 |
溶 |
| Ca2+ |
微 |
不 |
| Mg2+ |
不 |
微 |
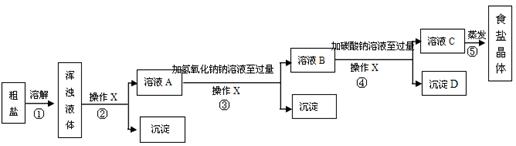
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
[交流与表达]
(1)实验操作X的名称是,该操作中要用到的玻璃仪器有烧杯、玻璃棒和。
(2)实验步骤③的主要目的是(用化学方程式回答);判断氢氧化钠溶液已过量的方法是。
(3)有同学认为原实验方案不完善,做出这种评价的依据是。
二、用途之二:制备氯气。
工业上用电解饱和食盐水来制备氯气,可以得到多种化工产品,除氯气(Cl2)外,还生成密度最小的气体,向反应后的溶液中滴加无色酚酞试液,溶液变红,请写出发生反应的化学方程式。
三、用途之三:工业制碱。
某厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
【相关资料】
⑴ NH4Cl△NH3↑+HCl↑
⑵已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
| 溶解度 |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
【生产原理】是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为:;分离出NaHCO3,加热制得纯碱。
【生产流程】如下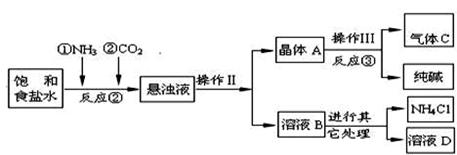
【问题讨论】:
(1)反应③中得到纯碱的化学方程式为:。
(2)检验气体C的方法。
(3)在反应②中,先通气体,目的是。
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质(写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算判断此纯碱样品的纯度为。(保留一位小数)
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是。
有一实验事实:铁粉与硫酸铜溶液反应,不但有铜生成,而且有较多的气体产生。为确定气体的成分,进行下列实验探究。
(一)探究:从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种。
(二)实验:
(1)甲同学为确定是否含有SO2,他将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中SO2(填“有”或“无”)。
(2)乙同学认为只有O2,则可用来检验。实验证明乙同学的观点不正确
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知:
O2+4KI+4HCl ="==" 2I2+4KCl+2H2O,I2为碘单质。于是他设计了如下的实验装置: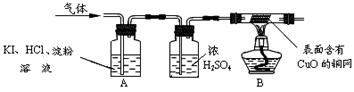
(三)实验现象与结论:A中观察到,证明无O2;
B中观察到,证明该气体是H2。
(四)实验反思:
(4)大家认为丙同学在加热之前,应对气体先以确保安全。
(5)由上述实验可知,硫酸铜溶液显性(填“酸”或“碱”)。
下图为用镀锌铁片制成的日常用品。镀锌铁是指通过镀锌工艺在铁皮上进行镀锌而制成的一种产品,热镀锌产品广泛用于建筑、家电、车船、容器制造业、机电业等,几乎涉及到衣食住行各个领域。
为测定铁片镀锌层的厚度实验过程如下。
【实验步骤】
⑴ 剪取一片镀锌铁片,量得长度=2.0cm,宽度=1.9cm。
⑵ 用电子天平称量质量0.857g。
⑶ 实验中需要溶质质量分数为10%的稀盐酸200mL(密度=1.05g/mL),需要量取溶质质量分数为37%的浓盐酸(密度=1.18g/mL)mL(保留至小数点后1位),然后稀释。
⑷ 将镀锌铁片放入溶质质量分数为10%盐酸中。当观察到,可以判断镀锌层恰好反应。
⑸ 将溶液中的铁片取出清洗、擦干、烘干后用电子天平称量质量0.837g。
【计算结果】
⑴ 铁片镀锌层的质量有g。
⑵ 已知锌的密度7.1g/cm3,计算出铁片镀锌层厚度mm(保留至小数点后2位)。
【实验反思】
实际计算结果偏大,同学们分析,这是因为很难通过观察现象判断镀锌层恰好反应,造成镀锌铁片浸泡在盐酸中时间。(填“偏长”、“偏短”)
【实验改进】
资料卡片:如图1所示,两种金属活动性不同的金属放入酸碱盐溶液中,会有电子的流动,从而产生电流。
将上述实验改进成如图2的装置,当观察到,此时锌层恰好反应。
某化学兴趣小组对“制镁企业不能使用CO2灭火器作为消防器材”的问题进行探究,请你参与他们的活动。
(1)二氧化碳的制备
①实验室常用下图所示实验装置A制备CO2,写出其中的仪器c的名称:;
②组装A装置时,仪器a、b插入双孔橡皮塞的先后顺序是(填序号);
③请写出检查A装置气密性的方法;
④若想控制反应的发生或停止,可选择下图哪些装置(填序号)。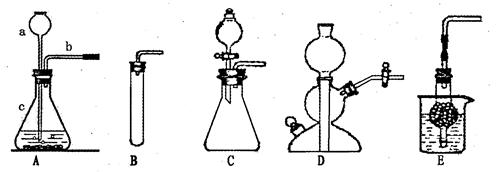
(2)探究镁与二氧化碳的反应
兴趣小组同学将点燃的镁条插入盛满CO2的集气瓶内,镁条继续剧烈燃烧,生成白色固体并有黑色物质附着于集气瓶内壁。同学们对镁与CO2反应的产物继续进行探究。
【提出猜想】
猜想I:产物是MgO和C;
猜想Ⅱ:产物是MgO、MgC2和C。
提出以上猜想的依据是。
【查阅资料】MgO+H2O=Mg(OH)2,Mg(OH)2在热水中的溶解度增大;
MgC2+2H2O=Mg(OH)2+C2H2↑。
【实验分析】为探究白色固体的成分,兴趣小组同学进行了如下实验:
①取少量反应后的固体混合物放人试管,加入足量热水,无气体放出,说明猜想不正确;
②为了验证另一种猜想中白色固体成分了请设计一个简单实验。
实验操作;
实验现象。
若该猜想正确,此时Mg与CO2反应的类型属于。
【实验反思】通过本实验,对“CO2不助燃”,你有什么新的认识:。