某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
| A.铝 | B.石墨 | C.银 | D.铂 |
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和4OH- - 4e-= 2H2O + O2↑ , 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn =Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
(7)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:____________________________。
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填编号)
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成和;不仅可以形成,还可以形成碳环。
(3)上图中互为同分异构体的是:A与;B与;D与。(填编号)
(5分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1))氢气在燃烧时,放出大量热量,说明该反应是 热反应,这是由于反应物的总能量 生成物的总能量(填“大于”、“小于”或“等于”,下同);从化学反应的本质角度来看,由于断裂反应物中的化学键吸收的总能量 形成产物的化学键放出的总能量
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势
。
下列各组物质(用序号填空):
① 红磷和白磷; ② 1H、2H、3H; ③ CH4和C10H22; ④乙烷和(CH3)2CHCH2CH3;
⑤  和
和 ;⑥
;⑥  和
和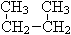
⑦ CH3 (CH2) 3 CH3和
(1)互为同位素的是;(2)互为同素异形体的是;(3)互为同系物的是;(4)互为同分异构体的是;(5)属于同一物质的是。
金刚烷是一种重要的化工原料,工业上可通过下列途径制备: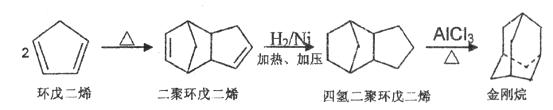
请回答下列问题:
(1)环戊二烯分子中最多有个原子共平面;
(2)金刚烷的分子式为,其分子中的-CH2-基团有个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线: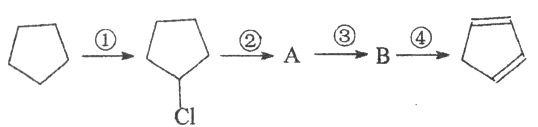
①A的结构简式为,B的结构简式为;②反应④的化学方程式;
③写出环戊二烯与等物质的量的Br2反应的化学方程式。
(4)W是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,苯环上两个对位取代基,其中一个为—CH3。写出W所有可能的结构简式(含顺反异构):
有机化合物A~H的转换关系如下所示: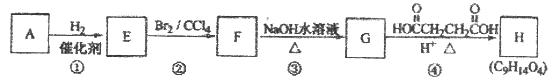
请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量为68,则A的分子式为,结构简式是:
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。由E转化为F的化学方程式是;
(3)①的反应类型是;③的反应类型是
(4)G与金属钠反应能放出气体,由G转化为H的化学方程式是