金属镍,铁及非金属元素碳在合金材料,有机合成材料中有广泛的应用.请回答下列问题:
(1)Ni原子的核外电子排布式为 .
(2)Fe原子的外围电子排布图为 .
(3)含碳化合物丙烯腈(H2C=CH—C≡N)分子中碳原子轨道杂化类型为
(4)NiO,FeO的晶体类型均与氯化钠晶体相同,Ni2+和Fe2+离子半径分别为69 Pm和78 Pm,则两种物质的熔点
NiO FeO(填“>”或“<”),判断依据是 .
(5)CaC2晶体的晶胞也与氯化钠相似,但由于CaC2晶体中的C22-存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C22-周围距离最近且相等的Ca2+数目为 ,C22-与O22+互为等电子体,写出O22+的电子式 .
(6)铁在一定条件下可形成体心立方堆积的晶体,设铁原子半径为r,请用含r的代数式表示该晶体空间利用率 .
(5分) 25℃时,若体积为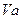 、
、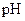 =" a" 的某一元强酸与体积为
=" a" 的某一元强酸与体积为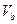 、
、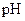 =" b" 的某一元强碱混合,恰好中和,且已知
=" b" 的某一元强碱混合,恰好中和,且已知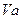 <
<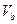 和 a = 0.5b。则:
和 a = 0.5b。则:
(1)a值可否等于3 (填“可”或“否”),其理由是 。
。
(2)a值可否等于5(填“可”或“否”),其理由是。
(3)a 的取值范围__________________________________________________。
从某铝镁合 金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是。
后来的反应速率相当快的原因是。
(3)写出所形成的原电池的负极材料名称:
电 极反应式:
极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据。(请逐一写出)
工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4.
(1)电解时,应以作阴极,电解过程中阴极附近溶液pH将会
(2)阳极反应式为(3)总电解反应式为
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题: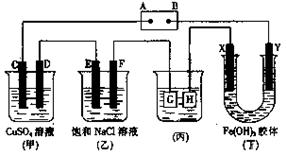
(1)电源A极的名称是。
(2)甲装置中电解反应的总化学方程式是_________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是______________。
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: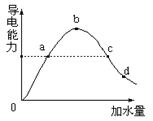
(1)加水前导电能力为零的理由是:
(2)a、b、c、d四点醋酸的电离度大小顺序是
(3)a、b、c、d四点溶液PH值大小顺序是
(4)若要把b点溶液中(CH3COO-)、(OH-)均减小,可采用的方法是 (选择正确的选项)
| A.加水 | B.加NaOH | C.加H2SO4 | D.加Na2CO3 |