若NA表示阿伏加德罗常数,下列说法正确的是( )
| A.标准状况下,120g二氧化硅固体中,含有2NA个二氧化硅分子 |
| B.标准状况下,18g重水含有10NA个中子 |
| C.室温下, 46克二氧化氮与四氧化二氮混合气体中原子数是3NA |
| D.常温常压下,过氧化钠与过量水反应,生成0.2摩氧气,转移电子0.2NA |
某同学为检验某溶液中是否含有常见的四种离子,进行了下图所示的实验操作,其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是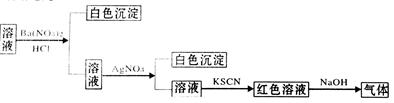
| A.原溶液中一定含有SO42— | B.原溶液中一定含有Cl— |
| C.原溶液中一定含有NH4+ | D.原溶液中一定含有Fe3+ |
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是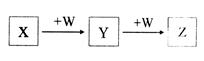
A.若 W是单质铁,则Z溶液可能是 W是单质铁,则Z溶液可能是 FeCl2溶液 FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可反应生成Y |
| C.若X是碳酸钠,则W可能是盐酸 |
| D.若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸 |
某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中对实验原理的解释和结论不正确的是
| A.氧化性:HClO>I2>SO42— |
| B.淀粉KI溶液变蓝是因为I—被氧化为I2,淀粉遇I2变蓝 |
| C.蓝色消失的原因是Na2SO3溶液具有漂白性 |
| D.若将Na2SO3溶液加入氯水中,氯水退色 |
为测写某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100mL0.3mol·L—1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加0.2mol·L—1NaOH溶液至沉淀质量恰在此时好不再变化,用去350mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005mol | B.0.01mol | C.0.025mol | D.0.03mol |
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3 NaH+H2O→NaOH+H2
有关它们的叙述正确的是
| A.离子半径:N3—>Na+>H+ |
| B.与水反应都是氧化还原反应 |
| C.与盐酸反应都只生成一种盐 |
| D.两种化合物中的阴阳离子均具有相同的电子层结构 |