市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。她的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传到Li+的高分子材料。这种锂离子电池反应式为:Li + 2Li0.35NiO2=" 2" Li0.85NiO2
下列说法不正确的是 ( )
| A.放电时,负极的电极反应式:Li -e- = Li+ |
| B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
| C.该电池不能用水作为电解质 |
| D.放电过程中Li+ 向负极移动 |
已知101KPa时辛烷的标准燃烧热为—5518kJ·mol-1,含20gNaOH的稀溶液与稀盐酸充分反应放出热量28.7kJ,则下列热化学方程式书写正确的是
①C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(g); △H = +5518 kJ·mol-1
②C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(l); △H = -5518 kJ·mol-1
③H+(aq)+ OH-(aq)= H2O(l); △H = -57.4 kJ·mol-1
④HCl (aq) + NaOH(aq) =NaCl(aq) + H2O(l); △H = —28.7 kJ·mol-1
| A.①③ | B.②③ | C.②④ | D.② |
反应A(g)+3B(g)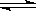 2C(g)的能量变化如图所示,
2C(g)的能量变化如图所示,
结合图像分析下列说法,其中正确的是
| A.若升高温度,则平衡常数增大 |
| B.该反应的焓变为b-a |
| C.达到平衡后,增大压强,平衡逆移 |
| D.催化剂不影响反应的焓变,影响反应的活化能 |
NA代表阿伏加德罗常数,则关于热化学方程C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H= -1300kJ·mol-1的说法中,正确的是
| A.有10NA个电子转移时,放出1300kJ的能量 |
| B.有44.8LCO2气体生成时,放出1300kJ的能量 |
| C.有NA个水分子生成且为液体时,吸收1300kJ的能量 |
| D.有4NA个碳氧共用电子对生成时,放出1300kJ的能量 |
25℃、101kPa下,反应2N2O5(g) = 4NO2(g)+O2(g),△H="+56.7" kJ/mol能自发进行的原因是
| A.反应吸热 | B.熵增效应大于能量效应 |
| C.熵减小 | D.反应放热 |
下列说法正确的是
| A.Al2O3硬度高,熔点2054℃,沸点2980℃,属于原子晶体 |
| B.在晶体中,只要有阴离子一定有阳离子 |
| C.某固态单质能导电,该单质一定属于金属晶体 |
| D.SiO2分子中每个Si原子周围有4个O原子,每个O原子周围有2个Si原子 |