下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲可作发酵粉,乙是一种常用的化肥。B、D常温下是气体。请回答下列问题: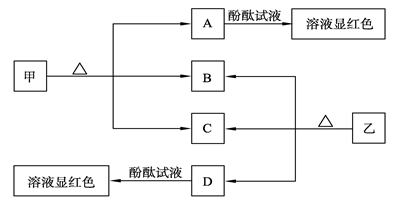
(1)甲的俗名是____________。
(2)D的水溶液滴入酚酞试液后,溶液显红色,请用必要的文字加以解释并写出相关的离子方程式:___ _________。
(3)甲溶液中加入氯化铝溶液,可以观察到的现象为 试写出反应的离子方程式:____
合成氨是人类科学技术上的一项重大突破,工业上以天然气为原料合成氨。其生产
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
①在一个密闭容器中进行上述反应, 测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)
α乙(CH4)
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g) CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g) 2NH3(g)∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
2NH3(g)∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量__________(填“>”“<”或“=”)92.4 kJ。
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是____________
a.v(N2)=3v(NH3)
b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变
d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
根据所学知识填空。
(1)写出此分子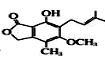 含有的官能团名称 。
含有的官能团名称 。
(2)写出铝热反应的化学方程式 。
(3)用离子方程式表示泡沫灭火器的灭火原理 。
(4)根据沉淀溶解平衡原理,用离子方程式解释碳酸钙溶于盐酸的过程 。
(5)写出有机物名称为 2,5 -二甲基-4-乙基庚烷的结构简式 。
(6)常温下,将pH=5的盐酸和pH=9的NaOH溶液以一定的体积比混合后,所得溶液的pH=6,则盐酸和氢氧化钠溶液的体积比是 。
(7)下列8组物质,互为同分异构体的是 组。
①甲烷和十七烷 ②金刚石和石墨③O2和O3④甲苯和苯乙烯
⑤邻二甲苯和间二甲苯 ⑥12C 和14C ⑦ 和
和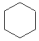 ⑧2-丁炔和1,3-丁二烯
⑧2-丁炔和1,3-丁二烯
将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。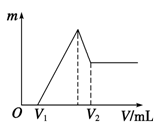
当V1=140 mL时,则金属粉末中:n(Mg) =________ mol,V2=______ ml。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,用100 mL 2 mol·L-1的H2SO4,再加入480 mL 1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是_________。
(1)KClO3与浓盐酸发生反应:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O,该反应中被氧化的元素和被还原的元素的质量之比为__________。转移1 mol电子时,产生标准状况下的Cl2__________ L。
(2)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应: NaClO2+HCl→ClO2↑+NaCl+H2O
写出配平的化学方程式________________。生成0.2 mol ClO2转移电子的物质的量为________ mol。
(3)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为___________________________。
在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、 Ag+、 Mg2+、 Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在 ,(填“是”或“否”),若存在求其最小浓度,若不存在说明理由 。