在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、 Ag+、 Mg2+、 Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出0.56L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在 ,(填“是”或“否”),若存在求其最小浓度,若不存在说明理由 。
按要求完成以下方程式:
(1)磁性氧化铁溶于盐酸的化学方程式:_________________________________________。
(2)氯化铁溶液中通入SO2气体的离子方程式:_______________ ____________________。
(3)偏铝酸钠溶液中通入过量CO2的离子方程式:_________________________________。
(4)碳单质和浓硝酸反应的化学方程式:_________________________________________。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示):
。
(3)E和氨水反应的离子方程式是________________________________________。
(4)设计实验检验B中所含的阳离子:
。
甲、乙、丙、丁四种物质之间具有如右转化关系: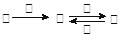
请回答下列问题:
(1)若乙为两性不溶物,则丙转化为乙的离子方程式为;
(2)若丙为形成酸雨的主要物质,则甲的化学式,乙能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式为:
;
(3)若丙中含有目前人类使用最广泛的金属元素,且乙转化成丙为化合反应,则将丙溶液蒸发、灼烧得到的物质是,除去丙溶液中少量乙的方法是:(用化学方程式表示),如何检验乙溶液中的丙,请设计实验方案。
已知: NO3-+4H++3e-→NO+2H2O 。现有四种物质:KMnO4、Na2CO3、Cu2O、Fe2(SO4)3,其中能使上述还原过程发生的是(填化学式),写出该反应化学方程式中氧化产物的化学计量数(写方框内)及其化学式□。1mol该物质与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:。
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系: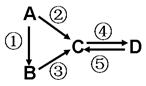
⑴若A是淡黄色固体,C、D是氧化物, C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途。
⑵若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式。
⑶若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是。
⑷若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式。D的化学式是。
⑸若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式。