浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。请你协助他们探究所得气体的成分。
Ⅰ【提出猜想】
猜想1:所得气体中可能是SO2。 猜想2:所得气体中可能是__________。
猜想3:所得气体中可能是_______的混合气体。
Ⅱ【实验探究】
(1)将所得气体通入如下装置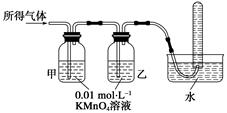
证明猜想3正确的实验现象是___________、______________、________________。
(2)点燃余下的气体前,必须要进行的操作是_________________________________。
(3)写出浓硫酸表现出强氧化性的化学反应方程式_____________________________。
(4)如果把一定量的铁与浓硫酸加热时产生的气体通过装有过量Na2O2粉末的玻璃管,则玻璃管中反应的生成物可能含有(填化学式)__________________ ___________ _。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: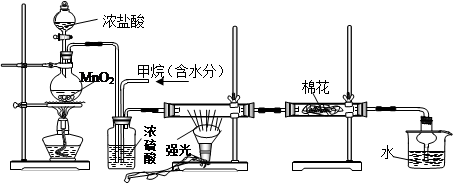
A B C D E
(1)写出A装置中发生反应的离子方程式
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应≥
(4)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有溶液。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式。
(6) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为(填字母)。
A.水洗分液法 B.蒸馏法 C.过滤法 D.结晶法
(7) 该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为(填字母)。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、 、Mg2+、
、Mg2+、 、Ba2+、
、Ba2+、 。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
注: + OH- = NH3↑+ H2O
+ OH- = NH3↑+ H2O
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol/L) |
(3)试确定K+是否存在?(填“是”或“否”),判断的理是。用什么样的方法可以验证K+是否存在:。
实验探究和推理都是科学研究的基本方法,请你对以下实验进行探究和推理
Ⅰ、有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42―、CO32―、Cl―和I―。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据上述实验事实,你可知道该溶液中肯定含有的离子是①;肯定不存在的离子是② ;还不能确定是否存在的离子是③ 。
Ⅱ、兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。
| 序号 |
实验操作 |
实验现象 |
| I |
稀硫酸中加入铜片 |
无明显变化 |
| II |
硝酸钠溶液中加入铜片 |
无明显变化 |
| III |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入铜片 |
有无色气泡;溶液变蓝 |
① 实验I、II的目的是。
② 实验III中反应的本质是(用离子方程式表示)。
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度分别为:
NH4Cl:10℃时33.3g、20℃时37.2g、30℃时41.4g;
NaF:20℃时4g;Na2SiF6:微溶。
请回答下列问题:
(1)指出副产品的用途:;(任填一种即可)
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒、漏斗外,还有 ___;
(3)操作II的名称是;
(4)操作Ⅲ的具体过程是、;
(5)上述流程中发生两步化学反应,请分别写出其化学方程式:
第一步:;
第二步:;
(6)流程中NH4HCO3必须过量,其原因是;
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
①→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ②→ 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
| 测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
| 初始读数(mL) |
0.40 |
0.10 |
0.90 |
0.00 |
| 最终读数(mL) |
25.05 |
20.10 |
21.00 |
19.90 |
| V标(mL) |
24.65 |
20.00 |
20.10 |
19.90 |
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数