2SO2(g)+ O2(g) 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
(1)图中A点表示_______________________,a="__________" 。
(2) Ea的大小对该反应的△H _______(填“有” 或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
(3)已知单质硫的标准燃烧热为296kJ·mol-1,写出反应的热化学方程式:________________________ ____,常温常压下,由单质硫和氧气经两步反应,若生成1mol SO3(g),放出的总热量为___ ___ 。
下图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:
(1)若试管内液面上升,则铁钉发生了 腐蚀,
正极反应式为 。
(2)若试管内的液面下降,则铁钉发生了 腐蚀,
负极反应式为 ,正极反应式为 。
(1)常说的三大合成材料包括塑料、____________和_____________。
(2)某些废弃的塑料通过分类、清洗、再加热熔融,可重新成为制品,这类塑料属于_________(填“热塑性”或“热固性”)塑料。
(3)CO中毒是因为CO与血红蛋白结合的能力远远大于_________(填一种气体名称)与血红蛋白结合的能力,导致人窒息。
(4)下列属于塑料制品的是_________(填序号),属于合成纤维的是_________(填序号)
A聚乙烯制品 B汽车轮胎 C玻璃钢 D涤纶 E羊毛
(5)较多量的轻金属盐如饱和的Na2SO4溶液可使蛋白质产生__________(填“盐析”或“变性”)
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12Lb.>1.12Lc.<1.12L
物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
(1)Y是 (化学式)。
(2)将X与Y混合,可生成淡黄色固体,书写相关化学方程式 。
(3)将X的水溶液久置于空气中会变浑浊,说明X具有 性质。
(4)烧杯中加一些蔗糖,滴几滴水,并倒入一些W的浓溶液,用玻璃棒搅拌,观察到的所有现象为 ,说明W的浓溶液具有 、 和 性质。
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是 (填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4 d.SO2 + Na2SO4
【化学-选修3:物质结构与性质】
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为________________。
(2)AB2分子中,A的杂化类型为________________;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)__________________。
(3)B的氢化物与D的氢化物的沸点较高的是____________(用化学式表示),原因是______________。
(4)AB2形成的晶体的熔点____________(填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是___________________。
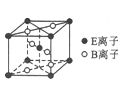
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为____________(用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:_________________________。
(6)由C、D两元素形成的化合物组成的晶体中,晶体结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为____________g/cm3.(已知阿伏加德罗常数为NA)