实验室中需要配制500 mL 0.10 mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)用托盘天平称量NaOH固态 g。称量NaOH固体需注意以下两个问题:①因为NaOH具有腐蚀性,所以称量时,应选用 盛装NaOH固体;②称量必须迅速,目的是防止 。
(2)实验所需要的仪器除托盘天平、药匙外,还需要的玻璃仪器有: 、 、 、 。
(3)下列操作对所配制的溶液浓度没有影响的是 。
| A.定容时仰视刻度线 |
| B.将烧杯中溶解后的溶液立刻注入容量瓶,然后再添加蒸馏水至刻度线 |
| C.摇匀定容后,用胶头滴管向容量瓶中滴加蒸馏水至刻度线 |
| D.配制溶液前用蒸馏水润洗容量瓶 |
如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的摩擦)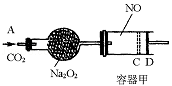
已知:2Na2O2+2CO2→2Na2CO3+O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24g。
①此时,通入标准状况下的CO2气体为 L。
②容器甲中NO2转化为N2O4的转化率是 。
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是 。
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于 g。
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)
| 实验编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
3 |
|||
| ③ |
298 |
10 |
6.0 |
0.30 |
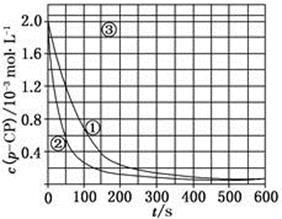
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=_______mol·L-1·s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________;
(4)实验③得出的结论是:pH等于10时,反应 (填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法: 。
化学理论在元素单质及其化合物反应中应用广泛。
(1)在一定条件下,可逆反应mA nB+pC△H,达到平衡状态。
nB+pC△H,达到平衡状态。
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m n+p(填“大于”、“小于”或“等于”)。
②其他条件不变,加热后A的质量减小,则反应△H 0(填“大于”、“小于”或“等于”)。
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 (填序号)。
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)△H。已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g)△H。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1100 |
| 平衡常数 |
0.68 |
0.50 |
请回答下列问题:
①该反应的△H 0(填“>”、“<”或“=”)。
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L﹣1,则温度T (填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1 W2(填“>”、“<”或“=”)。
汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5KJ/mol(条件为使用催化剂)
2CO2(g)+N2(g) △H=-746.5KJ/mol(条件为使用催化剂)
2C (s)+O2(g) 2CO(g)△H=-221.0KJ/mol
2CO(g)△H=-221.0KJ/mol
C (s)+O2(g) CO2(g)△H=-393.5KJ/mol
CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| C(NO)10-4 mol/L |
10.0 |
4.50 |
C1 |
1.50 |
1.00 |
1.00 |
| C(CO)10-3 mol/L |
3.60 |
3.05 |
C2 |
2.75 |
2.70 |
2.70 |
则c1合理的数值为 (填字母标号)。
A.4.20 B.4.00 C.3.50 D.2.50
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:
| 实验 编号 |
T/°C |
NO初始浓 度/10-3mol•L-1 |
CO初始浓 度/10-3mol•L-1 |
催化剂的比 表面积/m2•g-1 |
| ① |
350 |
1.20 |
5.80 |
124 |
| ② |
280 |
1.20 |
5.80 |
124 |
| ③ |
280 |
1.20 |
5.80 |
82 |
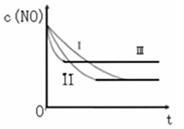
则曲线I对应的实验编号为 。
(4)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
CO |
H2 |
|||
| ① |
650 |
2 |
4 |
2.4 |
1.6 |
5 |
| ② |
900 |
1 |
2 |
1.6 |
0.4 |
3 |
| ③ |
900 |
a |
b |
c |
d |
t |
①实验组①中以v(CO2)表示的反应速率为 。
②若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为:α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。
①则负极的电极反应式为________________。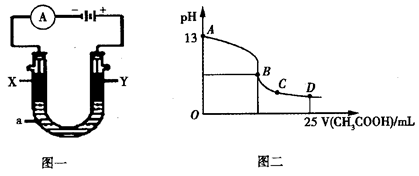
②以上述电池为电源,通过导线连接成图一。若X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式 。电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。根据图二计算,上述电解过程中消耗一氧化碳的质量为__________g。