FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: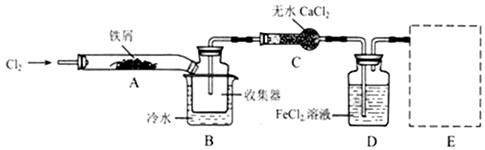
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(3)如果没有装置C的设计,会导致
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
| 实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 |
_________________。 |
说明:假设②不成立,假设①或③成立;反应的离子方程式是_____________。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 |
溶液紫红色退去 |
说明:________________________。 |
综合上述实验分析,所得溶液中含有的金属阳离子有 。
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验: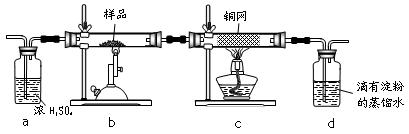
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的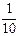 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。请回答下列问题: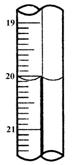
(1)称量样品所用的仪器为_____,将样品研细后再反应,其目的是_______。
(2)装置A的作用是________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)滴定时,标准碘溶液所耗体积为_________mL。
判断滴定已达终点的现象是_______。
通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____。(填编号)
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
实验室通过实验测定NaOH溶液和盐酸反应的中和热.实验需用约450mL 0.50mol/L NaOH溶液.容量瓶(100mL,250mL,500mL各一个)
(1)配制0.50 mol/L NaOH溶液:将NaOH固体放在(填实验用品或仪器的名称),用托盘天平g NaOH固体.在使用容量瓶前必须进行的操作是.
(2)下列操作会使所配溶液的浓度偏高的是(填序号).
A.烧杯、玻璃棒没有洗涤
B.转移时有溶液溅出容量瓶外
C.定容时,将容量瓶上、下颠倒摇匀后发现液面低于刻度线再加水
D.容量瓶用蒸馏水洗涤后再用相同溶质的溶液润洗
E.定容时俯视容量瓶刻度线.
(3)将50mL 0.50mol/L盐酸与60mL 0.50mol/L NaOH溶液在图所示的装置中进行中和反应.从实验装置上看,图中尚缺少的一种玻璃仪器是.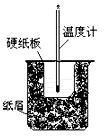
(4)一定量的稀盐酸和过量的NaOH溶液反应,当生成1mol H2O时放出的热量为57.3 kJ,则该反应的热化学方程式为.
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=-c kJ·mol-1
则a、b、c三者的大小关系为(填字母).
A.a>b>c B.b>c>a C.a="b=c" D.无法比较
测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与I-反应成
I3-,并在溶液中建立如下平衡:I2 +I- I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用_________做指示剂,滴定终点的现象是________。
(2)下列对该同学设计方案的分析,正确的是__________(填字母)。
A.方案可行。能准确测定溶液中的c(I2)
B.不可行。因为I-能与Na2S2O3发生反应
C.不可行。只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):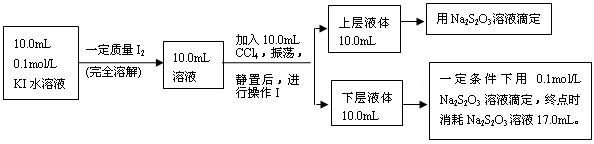
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即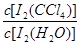 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是______(填名称)。
试指出该操作中应注意的事项为。(任写一条)
(4)下层液体中碘单质的物质的量浓度是__________。
(5)实验测得上层溶液中c(I3-)="0.049" mol·L-1,结合上述有关数据,计算室温条件下反应I2+I- I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
I3-的平衡常数K=__________(用具体数据列出计算式即可)。)
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为: 。
。
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。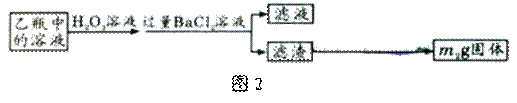
[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如图3所示。
问题讨论:
(1)Ⅰ中,甲瓶内所盛试剂是溶液。乙瓶内发生反应的离子方程式有:、。
(2)Ⅱ中的滤渣在称量前还应进行的操作是。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有。
④中取稀释液25.00ml需用的仪器是。
(5)该黄铁矿中硫元素的质量分数为。
黑火药是我国古代科技四大发明之一,在化学史上占有重要地位,黑火药主要是硝酸钾、硫磺、木炭三者粉末的混合物,在点燃条件下,其化学反应式主要为:KNO3 +S+C →N2↑+CO2↑+K2S
试填下列空白.
(1)在黑火药燃烧的反应中,氧化剂为,被氧化的物质为
(2)根据化学反应式分析,KNO3、S和C恰好完全反应时,它们的物质的量之比为
(3)黑火药燃烧后的固体残留物中,除了K2S外,还有少许K2CO3、K2SO4和未燃烧的炭末,请设计一个简单的实验证明,黑火药燃烧的固体产物中存在K2CO3和K2SO4
[实验方案]
①取黑火药燃烧后的固体残留物于烧杯中,加适量水溶解,过滤,得无色澄清溶液;
②用洁净的铂丝蘸取滤液,将铂丝放在酒精灯火焰上灼烧,透过蓝色钴玻璃片观察火焰,若火焰呈紫色,,则证明含K+;
③