某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是 ;
(3)实验室中现有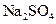 、
、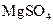 、
、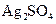 、
、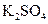 等4中溶液,可与实验中
等4中溶液,可与实验中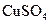 溶液起相似作用的是 ;
溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有 (答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。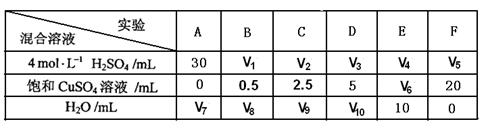
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量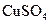 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的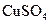 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| 实验操作 |
实验现象 |
|
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2+ + NO [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
Cl- |
Na+ |
SO42- |
Mg2+ |
Ca2+ |
HCO3- |
Br- |
| 含量/(mg·L-1) |
18980 |
10560 |
2560 |
1272 |
400 |
142 |
64 |
(1)以食盐为原料进行生产并综合利用的某些过程如下图所示。
①除去粗盐中的Ca2+、Mg2+和SO 离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
合理的一种顺序是(填序号) 。将滤液的pH调至酸性除去的离子是 。
②电解饱和食盐水的化学方程式是 ;
③侯德榜向饱和食盐水中通入NH3、CO2气体制NaHCO3晶体的化学方程式为 。
其依据是 。
④工业上可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2制取有效成分为NaClO的消毒液,反应的化学方程式是 。(碳酸的酸性强于次氯酸)。
(2)利用海水可以提取溴和镁,提取过程如下:
① 从MgCl2溶液中得到MgCl2·6H2O晶体的主要实验操作是 、洗涤、烘干。从MgCl2·6H2O晶体中得到无水MgCl2的主要方法是
②用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_____________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_____________。
③依据上述流程,若将5 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: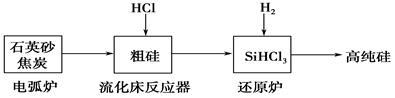
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2 355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。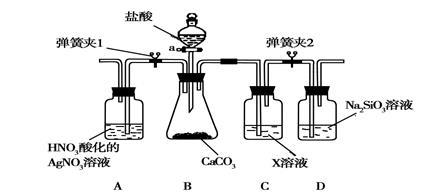
① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。
在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
试回答:
(1) 若用[Ⅰ]制取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时,如若发现c中液面不明显上升,你分析可能的原因是 ,检查的简单方法是 。
(2) 装置(Ⅰ)中b能防止多余气体逸散的原因是: 。
(3) 欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) 理由是: 。
[Ⅲ]是否可行(填“是”或“否”) 理由是: 。
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用。实验步骤如下:
①称量a g胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如图所示。
请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是__________________(填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为____________×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述测定溶液pH的操作:____________________________ 。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是 (按实验先后顺序填写字母序号)。
a过滤b烘干c溶解d洗涤e称量
(5)但有同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是 。