某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响。
(1)为达到本实验目的其装置连接顺序为:a连________,________连________.
(2)连接好装置后的下一步操作是
(3)锥形瓶中发生反应的离子方程式为
(4)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸和4mol/L硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 |
H2的体积(相同条件下) |
反应时间 |
反应速率 |
| 1mol/L硫酸酸 |
10mL |
t1 |
v1 |
| 4mol/L硫酸 |
10mL |
t2 |
v2 |
该小组同学通过实验得到的结果是:v1 小于v2,其定量依据是_______________________.
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
请在给定的坐标图中作出v(H2)-t的图像.
请解释0到4mim时该化学反应速率随时间变化的原因: .
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有: (任写一种).
实验室用固体烧碱配制0.1mol×L-1的NaOH溶液500mL,回答下列问题:
(1)计算需要NaOH固体的质量g。
(2)有以下仪器和用品:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平。配制时,必须使用的仪器或用品有
⑥托盘天平。配制时,必须使用的仪器或用品有 (填序号),还缺少的仪器是。
(填序号),还缺少的仪器是。
(3)使用容量瓶前必须进行的一步操作是。
(4)配制时,一般分为以下几个步骤:
① 称量② 计算③ 溶解④ 摇匀⑤ 转移⑥ 洗涤⑦ 定容⑧ 冷却⑨ 振荡,其正确的操作顺序为。
(5)配制过程中,下列操作会引起结果偏 高的是(填序号)
高的是(填序号)
① 未洗涤烧杯、玻璃棒
② NaOH溶液未冷却至室温就转移到容量瓶
③ 容量瓶不干燥,含有少量蒸馏水
④ 称量NaOH的时间太长
⑤ 定容时俯视刻度
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2 mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0 g固体试剂,用500 mL容量瓶中配成待测液备用。
(2)将标准盐酸装在已经润洗过的25.00 mL酸式滴定管中,调节液面位置在处,并 记下刻度。
记下刻度。
(3)取20.00 mL待测液,待测定。用甲基橙试剂作指示剂时,滴定到溶液颜色由刚好至色时为止。
(4)滴定达终点后,记下盐酸用去20.00 mL,计算NaOH的质量分数为。
(5)试分析滴定误差可能由下列哪 些实验
些实验 操作引起的。
操作引起的。
| A.转移待测液至容量瓶时,未洗涤烧杯 |
| B.酸式滴定管用蒸馏水洗涤后,直接装盐酸 |
| C.滴定时,反应容器摇动太激烈,有少量待测液溅出 |
| D.滴定到终点时,滴定管尖嘴悬有液滴 |
E.读滴定管开始时仰视,读终点时俯视
进行中和热的测定的装置如图所示。回答下列问题: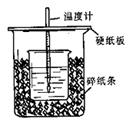
(1)从实验装置中尚缺少的一种玻璃用品是。
(2)烧杯间填满碎纸条的作用是。
(3)利用该装置测得的中和热数值(填“偏大、偏小、无影响”)
(4)某研究小组将装置完善后,把V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示
(实验中始终保持V1+V2=50 mL)。回答下列问题:
①研究小组做该实验时环境温度(填“高于”、“低于”或“等于”)22 ℃。
②由题干及图形可知,V1/V2=:时,酸碱恰好完全中和,此反应所用NaOH 溶液的浓度应为mol/L。
溶液的浓度应为mol/L。
某研究性学习小组利用如图所示装置完成有关实验。
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入。装置Ⅱ从管口进气可作为氨气的收集装置。实验过程中,使用分液漏斗滴加液体的操作是。
(2)该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有
(3)实验中若需用所给装置量取NH3的体积,试简述操作方法
所装液体最好是____(填字母编号)
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
本实验应对量气装置多次读数,读数时应注意:①将实验装置恢复到室温,②,③视线与凹液面最低处相平。
【实验二】比较盐酸、碳酸、硅酸的酸性强弱(可以不填满,也可以再加行)
(4)用所给装置设计实验,完成下列表格
装 置序号 置序号 |
仪器中所加物质名称 |
目的或现象 |
用下列两个装置分别进行苯的硝化和苯酚跟甲醛的缩聚实验.
(1)(甲)装置适用于进行 实验.,本实验需要的药品为6
实验.,本实验需要的药品为6 3%
3% 的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
的硝酸、98%的硫酸和苯,向试管中加入药品的顺序为①————————②——————-③————————;
若温度控制在50—600C,其反应的化学方程式为————————;
(2)(乙)装置适用于进行实验.,其化学方程式为—————。
(3)写出苯酚与浓溴水反应的化学方程式