设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.12.5mL 16mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA |
| B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA |
| C.1L 1 mol·L-1的醋酸溶液中离子总数为2NA |
| D.4.5 g SiO2晶体中含有的硅氧键数目为0.3 NA |
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是 ()
| A.H2R2的分子中既含有极性共价键,又含有非极性共价键 |
| B.Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 |
| C.T的氧化物是一种良好的半导体材料 |
| D.Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
下列说法中正确的是()
| A.CO2、NH3、CCl4、N2 中,所有原子都满足最外层8电子的稳定结构 |
| B.在元素周期表中金属和非金属交界处可以找到半导体材料 |
| C.共价化合物可能含离子键 |
| D.第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键 |
下列各种说法中,正确的是 ( )
| A.3号到9号元素化合价的变化与11到17号元素化合价的变化完全相同 |
| B.同周期原子半径逐渐减小,所以离子半径也逐渐减小 |
| C.随着原子序数的递增,碱金属元素单质的还原性逐渐增强,阳离子的氧化性逐渐减弱 |
| D.甲乙电子层数相同,甲的最高价氢氧化物的碱性比乙的最高价氢氧化物的碱性强,说明甲的核电荷数比乙大 |
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下: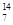 N +
N + 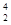 He →
He →  O +
O + 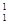 H,下列叙述正确的是( )
H,下列叙述正确的是( )
A. O2-离子结构示意图为: O2-离子结构示意图为: |
| B.氦气分子为双原子分子 |
C.一个H2 O(水分子)中含10e-,11个中子 O(水分子)中含10e-,11个中子 |
D.C O2(二氧化碳)的电子式: O2(二氧化碳)的电子式: |
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下: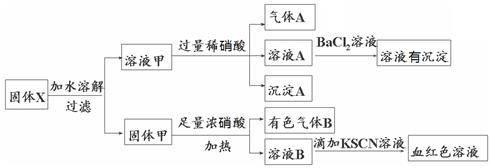
根据上述实验,以下说法正确的是
| A.气体A一定只是NO |
| B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3 |
| C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3 |
| D.溶液甲中一定含有K2SiO3、可能含有KAlO2、MgCl2 |