短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
| A.元素非金属性:Z> Y > X | B.最高价氧化物水化物酸性:Z > Y |
| C.原子半径:Z < Y < X | D.气态氢化物的稳定性:Z < Y < X |
酸HX的下列性质中,可以证明它是弱电解质的是 ( )
| A.1 mol/L HX溶液的pH值约为2 |
| B.HX能与水以任意比例互溶 |
| C.10 mL 1mol/L HX恰好与10 mL l mol/L NaOH溶液完全反应 |
| D.HX溶液的导电性比强酸溶液的弱 |
常温时,下列关于电解质溶液的叙述正确的是 ( )
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.常温下物质的量浓度相等的①(NH4)2CO3、②NH4A1(SO4)2、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>①>② |
| C.pH=ll的NaOH和pH=ll的氨水分别稀释100倍后的pH前者一定大于后者 |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
在已达到电离平衡的0.1 mol·L一的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是 ( )
| A.加少量盐酸 | B.加热 | C.加少量醋酸钠晶体 | D.加氢氧化钠 |
分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是 ( )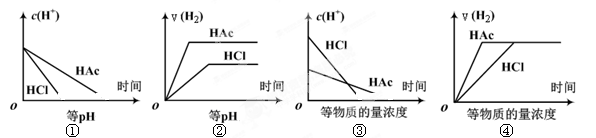
| A.①②③ | B.②④ | C. ①③ | D.①②③④ |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是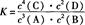 |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增大C,B的平衡转化率不变 |