(1)某一反应体系中有反应物和生成物共5种物质:S、H2S 、HNO3、NO 、H2O;则该反应中还原产物是_____;若反应过程中转移了0.3mol电子,则氧化产物的质量是_____g。
(2)将a mol Cl2通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,写出另2个可能发生的离子方程式。
①当 a / b =1时 ;
②当a / b≥3/2时 。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O  Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
(Ⅰ)已知B(OH)3是一元弱酸,试写出其电离方程式: ;
(Ⅱ)单质氰(CN)2是类卤素,试写出其与氢氧化钠溶液反应的离子方程式 。
(13分)已知: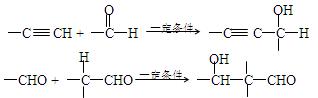
以乙炔为原料,通过下图所示步骤能合成有机物中间体E(转化过程中的反应条件及部分产物已略去)。
其中,A、B、C、D分别代表一种有机物;B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1)A→B的化学反应类型是。
(2)写出生成A的化学方程式: 。
。
(3)B在浓硫酸催化下加热,可生成多种有机物。写出2种相对分子质量比A小的有机物的结构简式:
、。
(4)写出C生成D的化学方程式:。
(5)含有苯环,且与E互为同分异构体的酯有种,写出其中二种同分异构体的结构简式:。
有机物A,俗称水杨酸,其结构简式为:
已知:
(1)将A跟下列物质的溶液反应可以得到一种钠盐(其化学式为C7H5O3Na)是
。
A.NaOH B.Na2CO3 C.NaHCO3 D.NaCl
(2)水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有种,其结构简式分别为。
(3)水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物一定含有基(填写除了羟基以外的官能团名称)
(4)水杨酸在酸性条件下与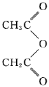 反应合成阿司匹林,则阿司匹林的结构为。可以检验阿司匹林样品中混有水杨酸的试剂是。
反应合成阿司匹林,则阿司匹林的结构为。可以检验阿司匹林样品中混有水杨酸的试剂是。
A.三氯化铁溶液 B.碳酸氢钠 C.石蕊试液
工业制硝酸的主要反应是:4NH3(g)+5O2(g)  4NO(g)+6H2O (g)+1025 kJ
4NO(g)+6H2O (g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。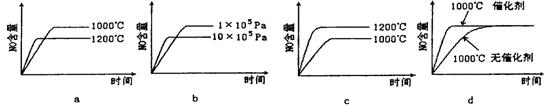
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.6 |
0 |
| 第2min |
0.6 |
a |
0.2 |
| 第4min |
0.3 |
0.975 |
0.5 |
| 第6min |
0.3 |
0.975 |
0.5 |
| 第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是_________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。
亚硫酸 钠和碘酸钾在酸性溶液中发生以下发应:
钠和碘酸钾在酸性溶液中发生以下发应:
Na2SO3+KIO3+H2SO4 → __Na2SO4 +K2SO4+I2 +
(1)配平上面的方程式,在横线上填入系数,在方框填上反应产物
(2)其中氧化剂是,若反应中有2.5mol电子转移,则生成的碘是mol;氧化产物为mol。
(3)该反应的过程和机理较复杂,一般认为发生以下四步反应:
① IO3- +SO32 - IO2- + SO42 - (反应速率慢)
IO2- + SO42 - (反应速率慢)
② IO2- + 2SO32 - I- + 2SO42 - (反应速率快)
I- + 2SO42 - (反应速率快)
③ 5I- +6H+ +IO3- 3I2 +3H2O(反应速率快)
3I2 +3H2O(反应速率快)
④ I2 +SO32 - +H2O I- + SO42 -+2H+(反应速率快)
I- + SO42 -+2H+(反应速率快)
根据上述步骤推测该反应总的反应速率由_____(填反应编号)步反应决定。
(4)预先加入淀粉溶液,由上述四步反应可以看出必须在_____离子消耗完后,才会使淀粉变蓝的现象产生。
U、V、W、X、Y是原子序数依次增大的五种短周期常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体
请回答下列问题:
(1)V元素原子的L层电子排布式为;XW的电子式为。
(2)U元素形成的同素异形体的晶 体类型可能是(填序号)__________。
体类型可能是(填序号)__________。
①原子晶体②离子晶体③分子晶体④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式);V、W的氢化物分子结合H+能力较强的是(写化学式),用一个离子方程式加以证明。
(4)YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为,由此可知VW和YW2还原性较强的是(写化学式)。