氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是 。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是: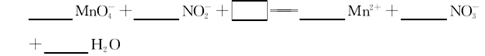
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是 。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。(用离子方程式表示)
(7分)现有五种短周期元素的性质、用途或原子结构信息如下表:
| 元素 |
元素的性质、用途或原子结构信息 |
| Q |
原子核外有6个电子 |
| R |
最外层电子数是次外层电子数的3倍 |
| X |
气态氢化物的水溶液常用作肥料,呈弱碱性 |
| Y |
第三周期元素的简单阴离子中离子半径最小 |
| Z |
单质为银白色固体,在空气中燃烧发出黄色火焰 |
请根据表中信息回答下列问题:
(1)Q最简单的气态氢化物分子的空间构型为________。
(2)R单质与X单质在雷电条件下反应产物为________化合物(填“共价”或“离子”)。
(3)写出R与Z组成仅含离子键的化合物的化学式:______________。
(4)工业上用电解Y与Z形成化合物的水溶液制取Y单质,写出该反应的离子方程式:_______________。
(5)在1.01×105Pa、298 K时,1.4 g QR气体在1.6 g R2气体中完全燃烧,生成QR2气体时放出14.15 kJ热量,写出QR的燃烧热化学方程式:____________________________。
某亚硝酸钠生产厂采用硝酸为原料,其生产原理是NO+NO2+2NaOH===2NaNO2+H2O。工艺流程如下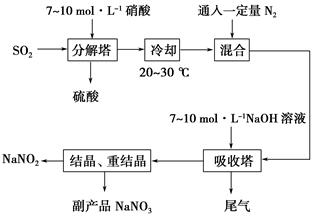
(1)分解塔中填有大量的瓷环,其目的是:_____________________________。
(2)按一定计量比在反应塔中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1∶1,则分解塔中发生反应的化学方程式为: ____________________________。试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因是_____________________________________,若硝酸浓度过高,吸收塔中可能发生的副反应化学方程式为_____________________________________________。
(3)通入一定量的N2的目的是: ___________________________________。
(4)吸收塔中尾气如何再利用:_______________________________________。
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。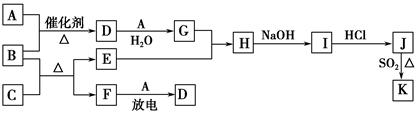
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)F的组成元素在元素周期表中的位置______________。
(2)E与G的稀溶液反应的离子方程式为______________________。
(3)B和C反应的化学方程式为____________________________________。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式______________。
正确书写下列化学反应的离子方程式
(1)Cl2和石灰乳的反应:_______________________________________________;
(2)把H2SO4、Na2SO3、Na2S三种溶液混合:________________________________________;
(3)向漂白粉溶液中通入少量SO2气体:______________________________________________;
(4)工业制粗硅的化学方程式:_____________________________________________________;
(5)将盐酸滴入Fe(NO3)2溶液中:___________________________________________________。