(选做)【化学—有机化学基础】
有机物H是用于合成药物的中间体,G为合成涤纶。请根据下列转化关系回答有关问题:

已知以下信息:
①B能与碳酸氢钠溶液反应产生二氧化碳,其苯环上一氯代物只有2种
②G为C和F一定条件下1:1反应生成的高分子化合物
③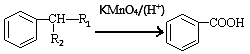
(-R1、-R2表示氢原子或烃基)
(1)A的化学名称为 ;C中含氧官能团名称为 。
(2)H的结构简式为 ;A→D的反应类型为 。
(3)写出C和F反应生成高分子化合物的化学方程式 。
(4)同时符合下列条件的B的同分异构体共有 种(不考虑立体异构);
①能发生银镜反应 ②含有苯环结构 ③能在碱性条件下水解
(5)其中核磁共振氢谱中出现4组峰,且峰面积之比为3:2:2:1的是 (写出结构简式)。
已知A、B、C、D、E五种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的元素在元素周期表中的位置是 ;
(2)B和C的分子式分别是_______和_______,C分子的立体构型呈_____形,属于_______分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成,则D的结构式是________,该反应的化学方程式为__________________;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,则E是 (填名称)。E可以作为燃料电池的燃料,请写出以E为燃料,O2做氧化剂,KOH为电解质溶液组成的燃料电池的负极反应方程式 。
(1)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后再加氨水,使生成2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2molAgCl。请写出表示此配合物结构的化学式:此配合物中的Co化合价为
(2)主族元素R的最高价氧化物R2O 4.7g溶于95.3g水中,所得溶液的质量分数为5.6%,R原子核中含有20个中子;主族元素Q,其单质与水剧烈反应放出O2,并能跟R形成典型离子化合物RQ。R的元素名称是_______,Q单质与水反应的化学方程式为______________。将4.7g R2O溶于_______g水中,可使每50个水分子中溶有1个R+离子。
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系。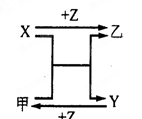
回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为,乙的电子式为。
(2) 若X基态原子外围电子排布式为3s1,Y具有许多优越的性能,被称为未来金属,甲中共含有90个电子,则其分子式为,Y的电子排布式为。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:,Y原子基态电子排布式为。
用VSEPR模型和杂化轨道理论相关知识填表:
| 分子或离子 |
孤对电子对数 |
VSEPR模型名称 |
中心原子杂化轨道类型 |
分子或离子的立体构型名称 |
| CH4 |
0 |
正四面体形 |
sp3 |
正四面体形 |
| BeCl2 |
||||
| SO2 |
||||
| CH3+ |
||||
| SO42- |
||||
| NCl3 |
(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=__________。
(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=__________。
(3)某温度(t℃)时,水的KW=10-13,则该温度______25℃(填大于、等于或小于),理由是_________________________________________________;将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,①若所得混合溶液为中性,则a :b =_________;
②若所得混合溶液pH=2,则a :b =__________。