某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C,且B、C的核磁共振谱显示都只有一种氢,B分子中碳碳键的键长有两种。以C为原料通过下列方案可以制备具有广谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示。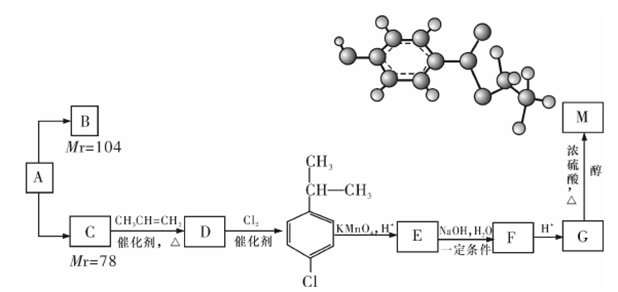
(1)B能使溴的四氯化碳溶液褪色,则B的结构简式为 。
(2)C→D的反应类型为 。
(3)写出E→F的化学方程式 。
(4)G中的含氧官能团的名称是 ,写出由G反应生成高分子的化学反应方程式 。
(5)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式: 。
①能发生银镜反应
②含有苯环且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1 mol该有机物与足量的钠反应生成1 mol氢气(一个碳原子上同时连接两个—OH的结构不稳定)
在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是______(填正确选项的标号)
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂也不是还原剂 |
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为______________(填“对”或“不对”),其理由是___________________________________________.
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是_______>________>______.
固氮有三种方式:生物固氮、工业合成氨和放电条件下氮气与氧气化合。全世界工业合成氮肥中的氮只占固氮总量的20%,其余绝大多数是通过生物固氮进行的,最常见的是豆科植物根部的根瘤菌,能将大气中游离态的氮经固氮酶的作用生成氮的化合物,以利于植物利用。
(1)根瘤菌与豆科植物的关系在生物学上称为__________________;
(2)根瘤菌之所以有固氮作用,是因为它有独特的固氮酶,而最根本原因是它含有独特的___________________;
(3)日本科学家把固氮基因转移到水稻根际微生物中,通过指导合成固氮所需的_____________进而引起固氮作用。更为理想的是直接将固氮基因转移到稻、麦等粮食及经济作物的细胞中,让植物本身直接固氮,这样可以免施氮肥。如果这种愿望实现的话说,那么固氮基因中遗传信息表达途径为___________________________________;
(4)这种生物固氮与工业合成氨比较,它是在_____________条件下进行的,从而节省了大量的器材、设备和能源;
(5)俗话说“雷雨发庄稼”,因为电闪雷鸣的雨天,氮气在空气中发生一系列的反应,产生了植物可利用的含氮化合物,写出有关的三个反应方程式____________________、____________________________、
____________________________________。
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于_________(填以下项目的编号)。
| A.破坏 臭氧层 | B.高温下能使一些金属被氧化 | C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+(亚铜离子)的酶的活化中心,亚硝酸根离子可转化为NO,写出Cu+和亚
硝酸根离子在酸性水溶液中反应的离子方程
式___________________________________________.
(3)在常温下,把NO气体压缩到100大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_________________.
(4)解释变化(3)中为什么最后气体总压力小于原压力大的2/3? __________________________.
(5)NO成为“臭名昭著的明星分子”所包含的哲学原理是
___________________________
下列各离子方程式的书写有无错误?若有请分析错误的原因并加以改正。
(1)向溴化亚铁溶液中加入足量氯水:
2Br-+Cl2=2Cl-+Br2
(2)向FeCl3溶液中加入铁粉:
Fe3++Fe=2Fe2+
(3)向Ba(OH)2溶液中加入硫酸:
Ba2++SO42-=BaSO4↓
(4)向CuSO4溶液中加入金属钠:
2Na+Cu2+=Cu+2Na+
(5)向NaHCO3溶液中滴入氢氧化钠溶液:
H++OH-=H2O
(6)向CuSO4溶液中滴入硫化钠:
Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
先选择填空,再简要说明作此选择的理由。
(1)某试管内装有约占容积1/10的溶液,则溶液的体积是____________,因为____________________。
A、约1mL B、约3mL C、约25mL D、无法判断
(2)拟在烧杯中于加热条件下配制某溶液50mL,应选择的烧杯是____________,因为________________________。
A、400mL烧杯 B、250mL烧杯 C、100mL烧杯 D、50mL烧杯