(1)用甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
CH4(g)+1/2O2(g)  CO(g)+2H2(g);△H= -36kJ/mol……… ①
CO(g)+2H2(g);△H= -36kJ/mol……… ①
CH4(g)+H2O(g)  CO(g)+3H2(g);△H= +216kJ/mol…………②
CO(g)+3H2(g);△H= +216kJ/mol…………②
①下列说法正确的是 ____
| A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol |
| B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态 |
| C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大 |
| D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲 |
烷的物质的量之比为6∶1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应CH4(g)+H2O(g) CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为 _______
(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;
8Fe+3NaNO3+5NaOH+2H2O 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;
以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平: __________________
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表: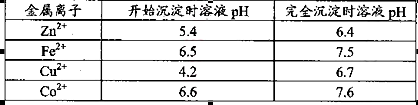
该温度下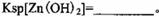 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中 ,则处理1
,则处理1 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是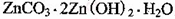 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
(12分)l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189.cm ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在 实验室中可用下列反应制备1,2二溴乙烷。
某化学兴趣小组用如图所示的装置(部分固定和夹持装置省略)进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
回答下列问题:
(1)已知该实验的副反应之一是乙醇会被浓硫酸氧化成CO2。写出该反应的化学方程式:
_________________________________________________________________。
(2)甲同学认为:溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理
由是________(填正确答案的标号,下同)。
| A.乙烯与溴水易发生取代反应 |
| B.使溴水褪色的物质,未必是乙烯 |
| C.使溴水褪色的反应,未必是加成反应 |
| D.浓硫酸氧化乙醇生成的乙醛,也会使溴水褪色 |
(3)乙同学经过仔细观察后认为试管中另一现象可证明反应中有乙烯生成,该现象是
(4)丙同学对上述实验进行了改进,在I和II之间增加如图所示的装置,则A中的试剂为________,其作用是________B中的试剂为________,其作用是________。
(5)丁同学通过洗涤、蒸馏等操作对l,2一二溴乙烷粗品进行了精制。该洗涤操作用到的主要玻璃仪器是_________,该仪器在使用前须清洗干净并_________。
【化学——选修5:有机化学基础】
有机化合物A的分子式为C4H9Br,A分子的核磁共振氢谱有3个吸收峰,其面积之比为2:1:6,利用A按照下列合成路线可以合成调味剂 ,注:部分物质省略。
,注:部分物质省略。
已知:①B在一定条件下可以合成一种高分子化合物,C和D互为同分异构体;
试回答下列问题:
(1)化合物B的系统命名是__________,B生成高分子化合物的化学方程式为__________
____________________________________________________________.
(2)D的结构简式为________________________。
(3)由B经两步反应转化为C经历的反应类型为__________ 和___________。
(4)E转化为F的化学方程式为_________。
(5)F的同分异构体需符合下列条件:①分子中含有苯环,苯环上共有2个取代基,且处于对位;②能与溶液反应生成CO2。符合条件的同分异构体共有_________种,其中一种异构体的核磁共振氢谱只有5个吸收峰,且吸收峰面积之比为3:2: 2:1:6,则该异构体的结构简式为 __________________.
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。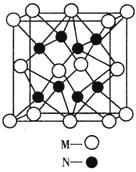
(5)该晶胞的边长为a×10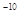 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。
【化学——选修2:化学与技术】
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业。请回答下列问题。
(1)列举两种海水淡化的方法:_________、_________。
(2)氯碱工业通过电解饱和食盐水能获得烧碱和氯气等物质,该反应的化学方程式为_____________,如图是用离子交换膜法电解饱和食盐水的原理示意图。其中石墨接电源_________极,电解时铁电极的电极反应式为_________。电解过程中通过离子交换膜的主要离子是__________。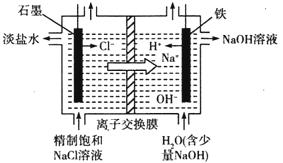
(3)侯氏制碱法中,首先向饱和食盐水中通入CO2和NH3制备NaHCO3,其化学方程式为____________;先通入的是__________(填化学式),其理由是__________________ ;再利用NaHCO3受热分解可制备纯碱。
(4)目前世界上60%以上的镁都是从海水中提取的,已知:MgO和MgCl2的熔点分别为2852℃和714℃。分析说明工业上采用电解熔融MgCl2而不是电解熔融MgO的理由__________ ______________________________________________________________________ 。