某研究性学习小组采用温和水溶液法,以CuCl2·2H2O和H2C2O4·2H2O为原料合成新颖结构的草酸铜晶体。为进一步探究草酸铜晶体的性质,现将草酸铜晶体在一定条件下加热分解,对所得气体产物和红色固体产物进行实验和研究。
Ⅰ、用以下装置检验气体产物的成分。
(1)C装置的作用是检验 ,D装置的作用是检验 。(用化学式回答)
(2)用PdCl2溶液检验CO时发生反应的化学方程式为______________________________;
(3)D、E两装置位置能否互换?为什么?_____________________________________。
(4)若需测定气体产物的含量,则A装置能很好地降低实验误差,在实验中,至少有____次使用到A装置,分别起什么作用?_____________________________。
Ⅱ、对固体产物的成分进行探究
①提出合理假设:
假设1:红色固体为Cu ;
假设2:红色固体为Cu2O ;
假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| …… |
|
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液。以0.14mol/L的NaOH溶液滴定上述稀H2SO4 25mL,滴定终止时消耗NaOH溶液15mL,其操作分解为如下几步:
| A.移取稀H2SO4 25.00 mL,注入洁净的锥形瓶中,并加入2-3滴指示剂。 |
| B.用蒸馏水洗涤滴定管,后用标准溶液润洗2-3次。 |
| C.取标准NaOH溶液注入碱式滴定管至 “0”或“0”刻度线以上。 |
| D.调节液面至 “0”或“0”以下某一刻度,记下读数。 |
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点,记下滴定管液面读数。
就此实验完成填空:
(1)①滴定操作的正确顺序是(用序号填写)。
②该滴定操作中应选用的指示剂是。
③在F操作中如何确定终点?。
(2)该滴定过程中,造成测定结果偏高的原因可能有哪些。
①配制标准溶液的NaOH中混有Na2CO3杂质
②滴定终点读数时,俯视滴定管的刻度,其他操作正确
③ 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
④滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑤滴定前碱式滴定管尖嘴部分未充满溶液
⑥滴定中不慎将锥形瓶内液体摇出少量于瓶外
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 mol/L(保留2位小数)
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
P H=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________ (选填“是”或“否”)。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________。
某溶液中可能含有A13+、NH4+、Fe2+、CO32-、SO42-、C1-中的一种或几种,取该溶液进行以下连续实验:
(1)取溶液少量于试管中,测得溶液的pH为2,则溶液中不存在的离子是______________。
(2)继续向溶液中加入过量Ba(NO3)2溶液,有沉淀生成,同时有气体放出,写出产生气体的离子方程式。
(3)取(2)中的上层清液,加入过量NaOH溶液,有沉淀、气体生成,此沉淀和气体的化学式为、。
(4)继续向(3)中反应后的剩余溶液中通入足量CO2气体,又有白色沉淀生成,则原溶液中存在的离子是。
(5)上述实验中还不能确定是否存在的离子是。
某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
_____________ 、_____________ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为。
(2)①若用Fe、Cu作电极设计成原电池,以确定Fe、Cu的活动性。试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液。
上述装置中正极反应式为。
②某小组同学采用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用。
| A.0.5 mol·L-1氯化亚铁溶液 | B.0.5 mol·L-1氯化铜溶液 |
| C.0.5 mol·L-1盐酸 | D.0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液 |
(3)利用提供的试剂和用品:0.1 mol·L-1盐酸溶液、0.1 mol·L-1醋酸溶液、0.5 mol·L-1氯化铝溶液、0.5 mol·L-1氢氧化钠溶液、PH试纸。
请设计最简单实验证明氢氧化铝为弱碱
I.下列四支试管中,过氧化氢分解的化学反应速率最大的是
| 试管 |
温度 |
过氧化氢浓度 |
催化剂 |
| a |
室温(25℃) |
12% |
有 |
| b |
水浴加热(50℃) |
4% |
无 |
| c |
水浴加热(50℃) |
12% |
有 |
| d |
室温(25℃) |
4% |
无 |
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。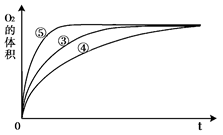
分析上图能够得出的实验结论是_________________________。