为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)A中发生反应的化学方程式为 。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(3)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性
Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(4)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
① 溶液E和F分别为 、 。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因
。
某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动
使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① ② IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-
② IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是,碘瓶不干燥会发生反应的化学方程式。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是。
(3)步骤Ⅲ中所加指示剂为,滴定终点的现象。
柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程: 请
请
根据以上流程,回答相关问题:
(1)操作④需要的玻璃仪器有:玻璃棒、烧杯、__________。
(2)操作③的名称:。
(3)对上述操作②后的无色溶液进行除杂提纯,甲同学提出新的方案。其方案如下:
[设计除杂过程]
(i)若在操作⑤结束后发现溶液E略有浑浊,应采取的措施是;
(ii)试剂X是(填化学式)。
[获取纯净氯化钾]
(ⅲ)对溶液E加热并不断滴加l mol· L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液F。
(ⅳ)将溶液F倒入(填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到,停止加热。
[问题讨论]
(ⅴ)进行操作⑤前,需先加热,使沉淀颗粒增大,便于过滤;该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时悬浊液D中Mg2+物质的量浓度mol/L。
(已知Ksp(MgCO3)= 3.5×10一5 Ksp[Mg(OH)2]= 1.6×10一11)
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题: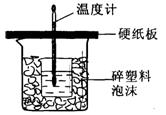
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________;本装置的不足之处是;不加以改正,所求的值将
(填偏大,偏小,无影响)。
(2) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会________(填“相等”或“不相等”)。
某课外研究性学习小组用下图所示装置制备少量溴苯并验证溴与苯的反应是取代反应。
实验时,关闭F活塞,打开C活塞,在装有少量苯的三口烧瓶中由A口加入少量液溴,再加入少量铁屑,塞住A口。
回答下列问题:
(1) D试管 内装的是,其作用是。
内装的是,其作用是。
(2) E试管内装的是。
(3)除去溴苯中混有的Br2杂质的试剂是,操作方法为。
(4)三口烧瓶中发生反应的化学方程式为:
(5)根据什么现象可证明验证溴与苯的反应是取代反应?。
(2分)下列实验操作或对实验事实的描述中正确的说法有。
①分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
②除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③将无水乙醇和3mol·L-1 H2SO4混合加热到170℃,可制得乙烯
④只用溴水就 可将苯、四氯化碳、乙醇、己烯四种液体区别开来
可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑤用分液法分离苯和硝基苯的混合物