某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是
(2)沉淀丙中一定含有 ,可能含有
(3)该溶液中肯定存在的离子有
(4)气体乙分子的结构式为
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为 ; ; (根据需要,可不填完,也可补充)
(1)①常温下,pH=3的盐酸和pH=11的氢氧化钡等 体积混合,溶液的pH=。
②常温下pH=3的盐酸和pH=6的盐酸等体积混合,溶液的pH=。(lg2=0.3)
(2)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①某溶液中的H+浓度为1×10-7mol/L,则该溶液呈性。
②0.01mol/LNaOH溶液的pH=。
③99mL pH=1的H2SO4溶液与101mL pH=12的KOH溶液混合后,溶液的pH=。
反应2A B+C,在某一温度时,达到平衡。
B+C,在某一温度时,达到平衡。
(1)若温度升高,化学平衡正向移动,则正反应是_____热反应;
(2)若B是 固体,降低压强时,平衡逆向移动,则A是_____态;
(3)若A是气态,加压时,平衡不移 动,则B为_______态,C为______态。
今有化合物:
(1)请写出丙中含氧官能团的名称:。
(2)请判别上述哪些化合物互为同分异构体:。
(3)请分别写出鉴别甲、乙、丙化合物的方法。(指明所选 试剂及主要现象即可)
鉴别甲的方法:
鉴别乙的方法:
鉴别丙的方法:
(4)请按酸性由强至弱排列甲、乙、丙的顺序:。
第4周期元素中,4p轨道半充满的是________(写元素符号,下同),3d轨道半充满的是____________,4s轨道半充满的是______________,价层中s电子数与d电子数相同的是______。
有几种元素的微粒的电子层结构如右图所示: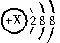
(1)若该微粒呈电中性,这种微粒的符号是____。
(2)若该微粒的盐溶液能使溴水退色,并出现浑浊,这种微粒的符号是_______。
(3)若该微粒的氧化性甚弱,但得到电子后变为原子,原子的还原性很强,这种微粒的符号是______。
(4)若该 微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种微粒的符号是______。