某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: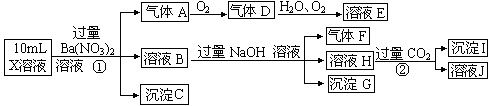
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子是___________,若要验证该离子是否存在,最可靠的化学方法是_______________________
(2)沉淀G的化学式为_____________。
(3)写出有关离子方程式:
①中生成A________________________ 。
②_________ 。
某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%,其余为氧。
(1)X的分子式是________。
(2)X能与金属钠反应放出氢气,则X结构中含有的官能团的名称为________。
(3)X与空气中的氧气在催化剂作用下反应生成了Y,该反应的化学方程式是______________________,反应类型为________。
(4)X与高锰酸钾酸性溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应生成132 g W,该反应的化学方程式为____________________________,其中X的转化率为________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是_________________________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________________________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(1)在固定体积的密闭容器中通入N2和H2,下列能说明达到平衡的是________。
| A.3v(N2)=v(H2) |
| B.断裂1个N≡N的同时断裂6个N—H |
| C.N2、H2、NH3的物质的量之比是1∶3∶2 |
| D.容器内气体的压强不变 |
E.气体的密度不变
F.气体的平均相对分子质量不变
(2)在2 L的密闭容器中通入2 mol N2、8 mol H2,5 min时达到平衡,测得NH3的物质的量是2 mol,则平衡时c(H2)=______________。
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下: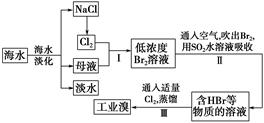
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图: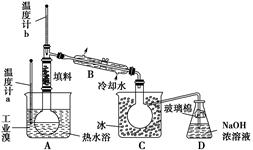
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺: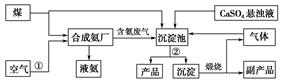
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。