下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| |
A |
B |
C |
D |
| Y |
CO2 |
Fe3O4 |
C2H5OH |
FeCl3 |
| W |
MgO |
Al2O3 |
C2H5ONa |
CuCl2 |
如图,在置于空气的容器里盛有NaCl溶液,再放入缠绕铜丝的铁钉,下列叙述错误的是
| A.铜丝上发生的反应为:O2+4e+2H2O→4OH- |
| B.铁钉上发生的反应为:Fe-3e→Fe3+ |
| C.NaCl的存在能加快铁钉的腐蚀速率 |
D.一段时间后铁钉上出现 红棕色物质 红棕色物质 |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
| 容器 |
起始各物质的物质的量/mol |
达平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述不正确的是()
| A.容器①、②中反应的平衡常数相等 |
| B.平衡时,两个容器中NH3的体积分数均为1/7 |
C.容器②中达平衡时放出的热 量Q=23.15kJ 量Q=23.15kJ |
| D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶质为NaA、HA,则一定存在: c(A-)> c(Na+)> c(H+)> c(OH-)
B.溶液中不可能存在:c(Na+)> c(A-)> c(OH-)> c(H+)
C.若c(OH-)> c(H+),溶液中不可能存在: c(Na+)> c(OH-)> c(A-)> c(H+)
D.若溶液中c(A-)=c(Na+),则溶液一定呈中性
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:Ag Cl(s)
Cl(s)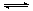 Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是: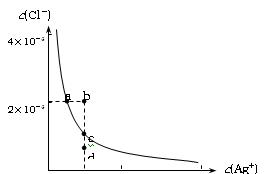
| A.加入NaCl可以使溶液由a点变到b点 |
| B.b点和d点均无AgCl沉淀生成 |
| C.a点对应的Ksp大于c点对应的Ksp |
D.向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀。其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq)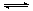 Ag2S(s)+2Cl-(aq) 。 Ag2S(s)+2Cl-(aq) 。 |
下列叙述正确的是
| A.c(NH)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.0.2 mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol·L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO)+c(OH-) |