下列结论不正确的是
| A.粒子半径:S>S2->Cl- |
| B.氢化物沸点:H2O>HF>HCl |
| C.结合质子能力:OH->SiO32>CO32- |
| D.离子还原性:S2->I->Br- |
下述实验方案能达到实验目的的是
| 编号 |
A |
B |
C |
D |
| 实验 方案 |
 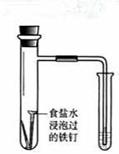 食盐水 |
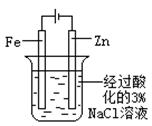 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
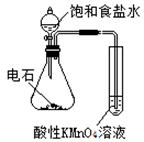 |
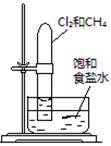 置于光亮处 |
| 实验 目的 |
验证铁钉发生 析氢腐蚀 |
验证Fe电极被保护 |
验证乙炔的还原性 |
验证甲烷与氯气发生 化学反应 |
有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 2 min末浓度/mol·L-1 |
0.08 |
a |
b |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
X、Y、Z、W是短周期元素,原子序数依次增大。X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子、W元素的+3价阳离子的核外电子排布均与氖原子相同。下列说法正确的是
| A.X、Y形成的化合物只含有极性键 |
| B.X单质和Z单质在暗处能剧烈反应 |
| C.含W元素的盐溶液一定显酸性 |
| D.Z离子半径小于W离子半径 |
铅蓄电池反应原理为:Pb(s)+PbO2(s) +2H2SO4(aq)  2PbSO4(s)+2H2O(l),下列说法正确的是
2PbSO4(s)+2H2O(l),下列说法正确的是
| A.放电时,负极的电极反应式为:Pb – 2e-=Pb2+ |
| B.放电时,正极得电子的物质是PbO2 |
| C.充电时,电解质溶液中硫酸浓度减小 |
| D.充电时,阴极的电极反应式为:PbSO4 – 2e- +2H2O=PbO2+4H++SO42- |