X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
| A.X的最常见气态氢化物的水溶液显酸性 |
| B.最高价氧化物对应水化物的酸性W比Z强 |
| C.Z的单质与氢气反应较W剧烈 |
| D.X的原子半径小于Y |
向100g浓度为18mol/L、密度为ρg/mL的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积
| A.小于100mL | B.等于100mL |
| C.大于100mL | D.等于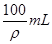 |
氢化钙(CaH2中H为-1价)可作为生氢剂,反应的化学方程式为
CaH2+2H2O=Ca(OH) 2+2H2↑,下列说法错误的是
| A.CaH2既是氧化剂,又是还原剂 | B.H2既是氧化产物,又是还原产物 |
| C.CaH2是还原剂,H2O是氧化剂 | D.氧化产物与还原产物的质量比为1∶1 |
能正确表示四种基本类型反应与氧化还原反应关系的示意图是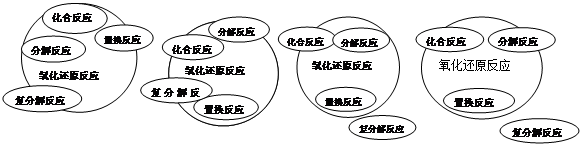
 A B C D
A B C D
“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到某分散剂中形成均一较稳定的体系,所形成的物质
①是溶液 ②是胶体③能产生丁达尔效应
④能透过滤纸⑤不能透过滤纸⑥静置后,会析出黑色沉淀
A①④⑥ B②③④ C②③⑤ D①③④⑥
在无色溶液中,能大量共存的离子组是
A.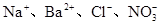 |
B.MnO4—、I—、K+、H+ |
| C.Fe3+、SO42—、NH4+、OH— | D.Ca2+、HCO3—、OH—、SO42— |