下列实验不能达到预期目的的是
| 序号 |
实验操作 |
实验目的 |
| A |
浓、稀HNO3分别与Cu反应 |
比较浓、稀HNO3的氧化性强弱 |
| B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C |
测定等浓度的HCl、HNO3两溶液的pH |
比较Cl、N的非金属性强弱 |
| D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
图中两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:Fe-2e-=Fe2+,则以下说法不正确的是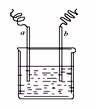
| A.该装置可能是电解池 |
| B.a极上一定发生还原反应 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |
关于如图所示装置的叙述正确的是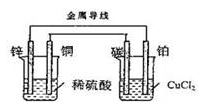
| A.电流由锌经导线流向铂,电子由铜经导线流向碳棒 |
| B.碳棒是正极,铜片是阳极 |
| C.锌片的质量逐渐减少,铂片的质量逐渐增加 |
| D.锌片上发生还原反应,碳棒上发生氧化反应 |
用铂惰性电极进行电解,下列说法正确的是
| A.电解饱和的食盐水,阳极产物是氢氧化钠和氯气 |
| B.电解饱和的氯化钠溶液,在阴极析出钠 |
| C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| D.电解熔融的氯化钠,在阴极上和阳极上析出产物的物质的量之比为2:1 |
、N2H2是一种高效清洁的火箭燃料。0.25 mol N2H2(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式正确的是
| A.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="+133.5" kJ·mol-1 |
| B.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="-133.5" kJ·mol-1 |
| C.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="+534" kJ·mol-1 |
| D.N2H2(g)+O2(g)=N2(g)+2H2O(g);ΔH="-534" kJ·mol-1 |
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度;影响反应速率的因素是
| A.①④ | B.③④ | C.①②③ | D.②③ |