A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题: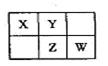
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3) AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是___ _。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式___ _。
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。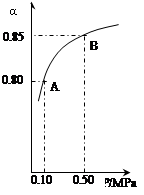
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10MPa。该反应的平衡常数等于_______。
②若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
③平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g)+2H20(g)△H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g)△H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中,放出的热量为______kJ。
(1)某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
(2)某温度下的水溶液中,c(H+) = 10x mol/L,c(OH—) = 10y mol/L,x和y的关系如图所示。计算: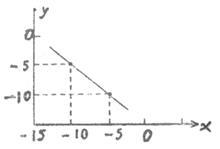
①该温度下水的离子积为_____
②该温度下,0.01mol/L的NaOH溶液的pH为_______
化学反应A(g)+B(g)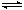 C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
t℃时物质的浓度(mol·L-1)变化
| 时间/min |
A |
B |
C |
D |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100[科网] |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
(1)计算t℃该化学反应的平衡常数: 。
(2)t℃ 850℃(填大于、小于或等于)。判断依据是 。
(3)反应在4min~5min之间,平衡 (填“向左”、“向右”或“不”)移动,可能的原因是 。
a.增加A的浓度 b.增加D的浓度 c.增加C的浓度 d.使用催化剂
(4)某温度下反应C(g)+D(g) 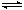 A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。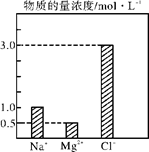
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
化学是一门以实验为基础的自然科学,右图为某试剂瓶上的标签,试回答下列问题。
(1)该盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中随所取体积的多少而变化的是________。
| A.溶液中HCl的物质的量 |
| B.溶液的浓度 |
| C.溶液中Cl-的数目 |
| D.溶液的密度 |
(3)某学生欲用上述较浓盐酸和蒸馏水配制500 mL物质的量浓度为0.150 mol·L-1的稀盐酸。
①该学生需要量取________mL上述较浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏小”,填B表示“偏大”,填C表示“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面( )。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )。
c.配溶液用的容量瓶用蒸馏水洗涤后未经干燥( )。