常温下,Na2CO3溶液中有平衡: 则下列说法正确的是( )
则下列说法正确的是( )
| A.Na2CO3溶液中:c(Na+) > c(CO32-) > c(OH-) > c(H+) |
| B.加入NaOH固体,溶液pH减小 |
| C.Na2CO3溶液中:c(Na+) +c(H+) =2c(CO32-) +c(OH-) |
| D.升高温度平衡向正反应方向移动 |
下列对于化学反应的研究结论正确的是
| A.已知常温常压下4Fe(s)+3O2(g)=2Fe2O3(s)是自发反应, 则该反应是吸热反应 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
C.一定条件下2molPCl3和2molCl2发生反应PCl3(g)+Cl2(g)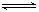 PCl5(g) ΔH= -93kJ•mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% PCl5(g) ΔH= -93kJ•mol—1 ,达平衡时放热139.5kJ,则PCl3的转化率为75% |
| D.用pH分别为2和3的醋酸中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1>10V2 |
向纯水中加入少量下列物质或改变下列条件,能促进水的电离,并能使溶液中c(OH—) > c(H+)的操作是: ①稀硫酸②金属钠③氨气④FeC13固体⑤NaClO固体⑥将水加热煮沸
| A.②⑤ | B.①④ | C.③④⑥ | D.④ |
下列有关描述及对应的离子方程式全部正确的是
| A.酸性高锰酸钾可使草酸溶液褪色:2MnO4-+ 5C2O42- + 16H+ = 2Mn2++ 10CO2 ↑+ 8H2O |
| B.在溶液中,FeI2与等物质的量的Cl2反应:2Fe2++2I—+2Cl2=2Fe3++I2+4Cl— |
| C.NaHCO3溶液中滴加少量澄清石灰水:2HCO3—+Ca2++2OH—= CaCO3↓+2H2O+ CO32— |
| D.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合: Al3++2SO+2Ba2++4OH-=2BaSO4↓+AlO2—+2H2O |
关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是
| A.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 |
| B.取等体积的两种酸溶液分别稀释至原溶液的m倍和n倍,稀释后两溶液的pH仍然相同,则m>n |
| C.取等体积的两种酸溶液分别与足量的锌粒反应,生成氢气的体积醋酸大于盐酸 |
| D.取等体积的两种酸溶液分别与NaOH溶液中和,消耗NaOH的物质的量醋酸大于盐酸 |
某温度下,在恒容密闭容器中充入NO2,发生反应2NO2(g)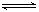 N2O4(g) ΔH <0,达到平衡后,下列说法不正确的是
N2O4(g) ΔH <0,达到平衡后,下列说法不正确的是
| A.再充入少量NO2,达平衡后NO2的转化率升高 |
| B.再充入少量NO2,达平衡后NO2的体积分数增大 |
| C.再充入少量N2O4,达平衡后NO2的体积分数减小 |
| D.升高温度,体系的颜色加深 |