汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)  2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
请回答:
(1)已知:N2(g)+2O2(g)  2NO2(g) ΔH1 2NO2(g)
2NO2(g) ΔH1 2NO2(g)  O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
(2)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率 ;
(3)假定该反应是在恒容条件下进行,下列能判断该反应已达到平衡的是________;
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v正(N2)=v逆(NO) |
(4)下图是反应N2(g)+O2(g)  2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
(5)T ℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol·L-1、0.20mol·L-1和0.50mol·L-1,此时反应N2(g)+O2(g)  2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
下面是印刷电路板的生产及其废液的处理的流程简图。请按要求填空: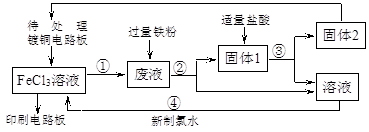
(1)镀铜电路版制成印刷电路版的离子方程式为;固体1的化学成分是(填化学式)。
(2)反应①的化学方程式为;要检验废液中是否含有Fe3+所需的试剂是(填化学式)溶液。
(3)反应④的离子方程式为。
已知氧化还原反应与四种基本反应类型的关系可用如图表示,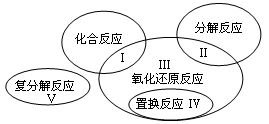
下列是有水参加或生成的几种反应:
①CaO + H2O ==Ca(OH)2
②2Na + H2O ="=" 2NaOH + H2↑
③H2 + CuO 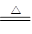 Cu +H2O
Cu +H2O
④3S+6NaOH 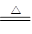 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH + HCl ="=" NaCl + H2O
请回答下列问题:
(1)反应①中水(填字母)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
(2)反应③被氧化的元素是(填元素符号)。
(3)上述反应中,属于区域Ⅲ的是 (填序号)。
(4)写出一种符合区域Ⅴ且既有沉淀生成又有水生成的离子方程式:。
请分别选用一种试剂除去下列物质中的杂质,并写出相应的离子方程式。
| 物质 |
杂质 |
所选试剂 |
离子方程式 |
|
| ① |
NaCl溶液 |
Na2CO3 |
||
| ② |
Mg粉 |
Al粉 |
按要求写出下列反应的化学方程式:
①将一小块钠投入水中:。
②氢氧化铝与氢氧化钠溶液反应:。
③过氧化钠与水反应:。
(1)CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施。
(2)水中含有的悬浮颗粒物等杂质,可以加入等混凝剂进行净化处理,利用其溶解后形成的______具有吸附作用使水中的悬浮颗粒物沉降。
(3)最近,国内第一个跨区域日处理垃圾1000吨以上的垃圾焚烧发电厂在江苏如皋投入使用。下面列出了现代生活中的常见垃圾:
| A.废纸 |
| B.废电池 |
| C.易拉罐 |
| D.玻璃瓶 |
E.塑料制品
在焚烧处理前,除废电池外,还有(填序号)应剔除并回收,随意丢弃电池会造成重金属离子污染的危害。