(1)主族元素A的简单阳离子不与任何原子具有相同的核外电子排布。元素B与氮元素同周期,B的原子序数大于氮,而第一电离能比氮的小。A与B形成两种化合物A2B2和A2B,其中B的杂化方式分别为 、 。A2B、NH3、SiH4的键角由大到小依次为 (填化学式)。A2B由液态形成晶体时密度减小,主要原因是 。
(2)新型无机材料在许多领域被广泛应用。陶瓷发动机的材料选用氮化硅,它硬度高、化学稳定性高,是很好的高温陶瓷材料。除氢氟酸外,氮化硅不与其他无机酸反应,抗腐蚀能力强。氮化硅的晶体类型是 ,氮化硅与氢氟酸反应的化学方程式为 。
(3)MgCO3和CaCO3都为离子晶体,热分解的温度分别为402℃和900℃,请根据结构与性质的关系说明它们热分解温度不同的原因 。
(4)砷化镓广泛用于雷达、电子计算机、人造卫星,宇宙飞船等尖端技术中。镓的基态原子价电子排布式为 ,砷化镓的晶胞结构与金刚石相似,其晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为 g(用NA表示阿伏加德罗常数),该晶胞中Ga与As的最短距离为 cm。
现有四种元素,分别位于元素周期表的前四个不同周期,其原子序数总和为48.由它们可组成甲、乙、丙、丁四种单质和A、B、C、D四种化合物,其中甲、乙为非金属单质,丙、丁为金属单质.这些物质间的转化关系如下图所示(反应条件已省略)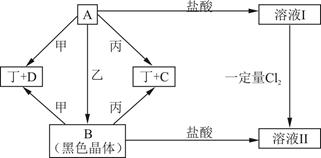
请回答下列问题:
(1)组成丁的元素在周期表中的位置________________.B的俗名_____________,C物质的用途之一_____________________.
(2)写出A+乙 B的化学方程式___________________________________.
B的化学方程式___________________________________.
(3)在加热条件下,丁与气态D可发生反应,该反应的化学方程式为___________.
(4)若21.6g A与适量的乙反应生成B,A、B按上述图示转化为溶液I和溶液II(假设各步反应均恰好进行完全);向溶液I中通入________mol Cl2,经充分反应可恰好使溶质的组成与溶液II完全相同.
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
已知:F变成G相当于在F分子中去掉1个X分子。
请回答下列问题:
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(2)B →C的反应类型是。
(3)1molG最多能与molNaOH反应。
(4)G的核磁共振氢谱中应有个峰,峰面积比为。
(5)写出E →F的化学方程式。
(6)含苯环、含酯基与D互为同分异构体的有机物有种,写出其中核磁其振氢谱有四个峰,且峰面积比为1﹕2﹕2﹕1有机物的结构简式。
(1)如图所示为冰晶石(化学式为 Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子、;大立方体的体心处▽所代表的是(用化学式表示)。
Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子、;大立方体的体心处▽所代表的是(用化学式表示)。
(2)H2S和H2O2的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2O2 |
272 |
423 |
以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因
。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有_______(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中____________加入甲醛,且反应釜应装有________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、______和石灰 石(或长石)高温熔融而成,主要反应的化学方程式为_____________________________________。
石(或长石)高温熔融而成,主要反应的化学方程式为_____________________________________。
(3)玻璃钢中玻璃纤维的作用是__________。玻璃钢具有___________等优异性能(写出亮点即可)。
(4)下列处理废旧热固性酚醛塑料的做法合理的是_________。
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
.I下表是部分短周期元素的原子半径及主要化合价:
| 元素代号[ |
W |
R |
X |
Y |
Z |
Q |
M |
| 原子半径/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.150 |
0.160 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
+3 |
+2 |
试用元素符号 、化学式回答下列问题:
、化学式回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有 ;
X可与W组成含18电子的化合物乙,则乙的电子式为 。
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g) 2G(g)根据下表中的数据判断下列图像错误的是 。
2G(g)根据下表中的数据判断下列图像错误的是 。
 |
p1(MPa) |
P2(MPa) |
| 200 |
78.4 |
90.6 |
| 600 |
72.3 |
88.6 |
|

