下图是中学化学某些物质之间在一定条件下的相互转化关系,已知A是一种常见的液态化合物, C、D、G、H、K是单质,其它为化合物,G、K是普通钢中的两种重要元素,其中K含量少,E、F对应溶液的酸碱性相反,F的焰色反应为黄色,请按要求作答: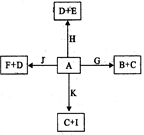
(1)写出化合物J的电子式:_______________。
(2)G3+比G2+的稳定性的原因 ,组成D、H、K三种元素的第一电离能由大到小的顺序为 (写元素符号)。A分子中心原子的杂化方式为 ,A可与Cu2+形成天蓝色的物质,画出该离子的结构示意图 ,写出一种与化合物I 为等电子体关系的阴离子
(3)B与足量稀硝酸反应,当参加反应的硝酸为4mol,转移电子的物质的量为 _________mol(保留2位有效数字)。
(4)已知在200℃,101Kpa下,0.12g单质K与A完全反应生成C与I,吸收了1316 J的能量,写出此反应的热化学方程式:_________________________。
(5)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的电极反应为:___________。
②若用此电池电解300mL 5mol/L的氯化钠溶液一段时间,两极均收集到标准状况下3.36L气体,此时溶液的pH为_________(假设电解前后溶液体积不变化)。
③若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),此时溶液中所有离子浓度的关系由大到小的顺序为:_______________________
某棕黄色气体A由两种前18号常见元素组成,测得同温同压下该气体对空气的相对密度为3.0,A溶于水只生成一种产物B,B的溶液在放置过程中其酸性会增强并放出一种单质气体C。A可用另一种单质气体D与潮湿的Na2CO3反应制得,同时生成两种钠盐;单质气体D也可和HgO反应制得A。请回答下列问题:
(1)气体A的化学式为_____________。
(2)用化学方程式表示B溶液酸性增强的原因_____________。
(3)气体单质D与潮湿的Na2CO3反应制得制取A的化学方程式为_____________。
(4)气体单质D与HgO反应制得A的化学方程式为_____________。
比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题。Na2O2几乎可与所有的常见气态非金属氧化物反应。如2Na2O2+2CO2 ="=" 2Na2CO3+O2,Na2O2+CO= Na2CO3。
(1)通过比较可知,当非金属元素处于____________价时,其氧化物与Na2O2反应有O2生成。
(2)试分别写出Na2O2与SO2、SO3反应的化学方程式:_____________;_____________。
(3)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。试写出(CN)2与水反应的化学方程式:________________________________________。
试用化学方法除去下列物质中混有的少量杂质,要求除杂试剂均过量,若为溶液中的离子反应请写出其离子方程式,否则写化学方程式。并写出相应的分离方法。
(1)除去FeCl2溶液中混有的少量FeCl3;方程式: ______________。分离方法:______
(2)除去CO2气体中混有的少量HCl;方程式:_______________。分离方法:______
(3)除去NaCl溶液中混有的少量NaBr;方程式:__________________。分离方法:______
次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为;在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:(填化学式)。
②NaH2PO2是(填“正盐”还是“酸式盐”),其溶液中离子浓度由大到小的顺序应为
③0.2 mol·L-1 H3PO2溶液与0.2mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H2PO2-)+c(OH-)-c(H+)=mol·L-1。(溶液体积变化忽略不计)
(2)次磷酸(H3PO2)可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因(用离子方程式表示)
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)  2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示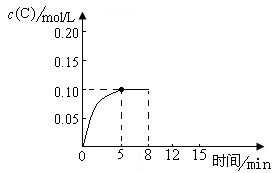
(1)已知该反应只有高温下能自发进行,则该反应的△H0(填“>”、“<”或“=”)。
(2)在上述反应条件下,从反应开始到平衡,用V(B)=mol·L-1·min-1,500℃时的平衡常数K=;
(3)在反应温度和容器体积不变的条件下,下列能说明上述反应达到平衡状态的是;
A.混合气体的压强保持不变
B.气体C的体积分数保持不变
C.混合气体的密度保持不变
D.B的正反应速率等于C的逆反应速率
(4)在500℃时,上述反应达到平衡后,在8min时将容器体积迅速压缩为1.0L,反应在12min建立新的平衡,画出8~15min内C气体物质的量浓度随时间变化的示意图。