(1)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。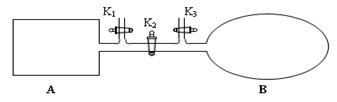
①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
(2)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。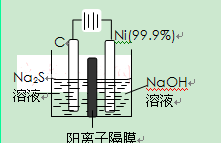
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,
则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在
氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
(1)在下面元素周期表中全部是金属元素的区域为。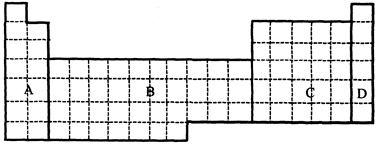
(a)A (b)B (c)C (d)D
(2)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍;Y元素单质为双原子分子,其氢化物水溶液呈碱性;1mol单质Z跟盐酸完全反应,能置换出22.4L的H2(标准状况);W元素原子核外M层电子数目比K层多1个;
①请写出元素X的一种核素的化学符号;
②写出元素Y在周期表中的位置;
③Z、W两元素相比较,金属性较强的元素是(填元素符号),可以验证该结论的实验是。
(a)比较两种元素单质的熔点
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)比较这两种元素的最高价氧化物对应水化物的碱性
(d)比较这两种元素的气态氢化物的稳定性
图表法是常用的科学研究方法,下表列出了同周期的四种短周期元素的部分性质(“电负性”即元素对应原子吸引电子能力的标度):
| 元素编号 |
A |
B |
C |
D |
E |
| 电负性 |
3.0 |
2.5 |
X[ |
1.5 |
0.9 |
| 原子半径(单位nm) |
0.099 |
0.102 |
0.110 |
0.143 |
0.186 |
| 主要化合价 |
-1,+7 |
-2,+6 |
-3,+5 |
+3 |
+1 |
请回答下列问题:
(1)写出E元素的离子结构示意图;
(2)X的值应为(填字母);
A.3.6 B.3.1 C.2.1 D.1.4
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:
(6)D、E最高价氧化物对应水化物相互反应的离子方程式:
下列六种物质中①Ar ②CO2 ③NH4Cl ④KOH ⑤Na2O2 ⑥MgCl2请回答:
(1)只存在共价键的是;(填写序号)
只存在离子键的是;(填写序号)
不存在化学键的是 。(填写序号)
(2)Na2O2的电子式为;
(3)KOH溶于水,破坏了;氯化铵受热分解破坏了。
已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图。请回答: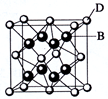
(1)A的元素符号是_____
(2)B与A形成的化合物比C 与A形成的化合物沸点高,其原因是_____
(3)E元素名称是;它的+2价离子的电子排布式为_____
(4)从图中可以看出,D跟B形成的离子化合物的化学式为;在晶体中与D距离最近且相等的B有个, D跟B形成的离子化合物的熔点D跟C形成的离子化合物的熔点(填“>”或“<”)。
(7分)
(1)NF3分子中N原子的杂化轨道类型为__________,该分子的空间构型为________
(2)[Cu(NH3)4]SO4属于配合物,其中原子提供孤对电子。配合物 Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,Fe(CO)5晶体属于(填晶体类型)。
(3)金属铜晶体的晶胞结构如图所示(面心立方晶胞):若该晶胞边长为dnm,铜的相对原子质量为64,阿伏加德罗常数为NA,则该晶体的密度为g/cm3(列表达式)