(共12分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- + H2O2 + H+ ="=" Mn2+ + O2 + ( )
(3)移取10mL过氧化氢溶液可以用_________________(填“酸式”或“碱式”)滴定管。不用碱式滴定管盛装KMnO4标准液的原因是 ,滴定到达终点的现象是__________ _____________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为_________________________________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果_________(填“偏高”或“偏低”或“不变”)。
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①碳与浓硝酸的反应,说明浓硝酸具有 性。
②反应产生的热量会使少量浓硝酸受热分解,写出反应的化学方程式 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出这两种盐的化学式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式 。
②试分析:是否需要增加带火焰的木炭与纯净O2反应的实验 。
③通过实验探究,你认为助燃气体是什么,简述理由 。
某研究小组想探究炭与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速放入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮,上下反复跳动。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①炭与浓硝酸的反应,说明浓硝酸具有 性。
②反应产生的热量会使少量浓硝酸受热分解,该反应的化学方程式为 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出反应的的离子方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式 。
②通过实验探究,你认为上表操作b中助燃气体是什么,简述理由 。
(15分)硫代硫酸钠俗称“海波”,又名“大苏打”,具有较强的还原性和配位能力,是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。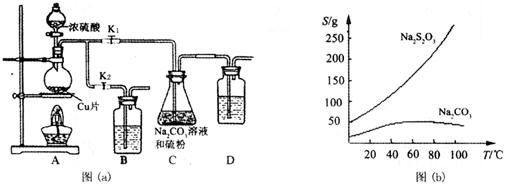
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式 。装置B、D的作用是 。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是 。
步骤4:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2 S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42—全部转化为Cr2O72—;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L—1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:
①Cr2O72— + 6I—+ 14H+ ="=" 2Cr3+ + 3I2 + 7H2O;
②I2 + 2S2O32— ="=" 2I—+ S4O62—
则该废水中Ba2+的物质的量浓度为 。
(15分)一种广泛用作药剂、有机氯化剂,及用于制造染料、橡胶的化工原料——硫酰氯(SO2Cl2),常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3kJ·mol-1
(1)仪器A的名称是 ;甲中活性炭的作用是__ ____。
(2)干燥管B中盛放的药品是 。
(3)实验时从仪器C中放出液体的操作方法是 。
(4)装置乙中盛放的物质为 ,若缺少装置乙,对实验结果有什么影响? 。
(5)氯磺酸(ClSO3H)是一种无色的发烟液体,有刺激性臭味,沸点178℃,受热分解也能制得硫酰氯,同时还有另外一种物质生成,该反应的化学方程式为 ,分离的产物的方法是 。
A.重结晶B.过滤 C.蒸馏D.萃取
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 (填序号)。
A.控制气流速度,宜慢不宜快
B.水浴加热三颈烧瓶
C.若三颈烧瓶发烫,可适当降温