(15分)某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
| V(AgNO3)/mL |
15.00 |
19.00 |
19.80 |
19.98 |
20.00 |
20.02 |
21.00 |
23.00 |
25.00 |
| E/mV |
-225 |
-200 |
-150 |
-100 |
50.0 |
175 |
275 |
300 |
325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一)中的仪器名称:仪器A ,仪器B 。
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为 mL,计算得海带中碘的百分含量为 %。
(3)①分液漏斗使用前须检漏,检漏方法为 。
②步骤X中,萃取后分液漏斗内观察到的现象是 。
③下列有关步骤Y的说法,正确的是 。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二)中操作Z的名称是 。
(4)方案甲中采用蒸馏不合理,理由是 。
如下图,通电5 min后,电极5质量增加2.16 g,回答: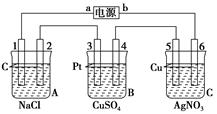
(1)电源:a是________极 ;A池中电极上产生气体能使湿润KI淀粉试纸变蓝;B池中电极上发生氧化反应,电解过程中pH(填增大、减小或不变)。
电池电极反应,电极1:;电极4:。
A池电池总反应。
C池电池总反应。
(2) 如果B池中共收集到224 mL气体(标准状况) ,且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为。
(一)写出有关反应的离子方程式:(1)硫酸氢钠溶液与碳酸氢钠溶液的反应;(2)硫化亚铁投入稀硫酸中反应;
(3)向Na2CO3溶液中加入少量稀盐酸;
(4)向碳酸氢钙溶液中加入少量烧碱溶液 。
(二)(6分)某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO、SO中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量B a(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
a(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是___________________________________________;
(2)一定存在的离子是___________________________________________________;
(3)判断沉淀乙成分的方法是。
下图是一个制取氯气并以氯气为原料进行特定反应的装置:
(1)A是氯气发生装置,化学反应方程为
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入
| A.D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:。装置C的作用是。 (3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是。 (4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为。(填代号) |
||
| B.有白色沉淀生成 | C.无现象 | D.先生成白色沉淀,而后白色沉淀消失 |
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是,
B的作用是。
某校学生利用以下装置验证氯气与氨气之间的反应(部分装置已略去)。其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置。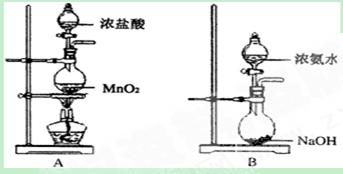
请回答下列问题:
(1)装置A中发生反应的离子方程式为。
(2)装置B中浓氨水与NaOH固体混合可制取氨气,其原因是。
(3)装置C中氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种可参与生态循环的无毒气体,该反应的化学方程式为
(4)将装置C中反应生成的固体溶于水,所得溶液中离子浓度由大到小的顺序为。
某化学研究性小组同学提出回收含铜电缆废料中提取铜的两种方案,并向老师咨询,老师就以下几个方面与同学们展开讨论:
方案甲: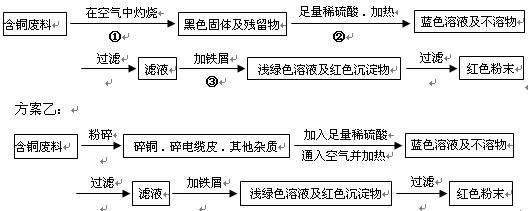
(1)两个方案哪个符合当前生产的绿色理念,为什么?
.
(2)写出方案甲中的②③步骤与铜有关的离子反应的离子方程式。 __________________ _ __________
__________________ _ __________
_________________ _________。
(3)老师建议,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,目的是:。
(4)老师请同学们用化学方法检验红色粉末中是否含有过量的铁屑。请你填写下列表格写出实验操作、预期实验现象、结论及操作(②中相关的离子方程式)。
| 序号 |
实验操作 |
实验现象 |
结论及离子方程式 |
| ① |
取适量的样品于试管内 |
—— |
—— |
| ② |
用滴管滴入足量硫酸溶液,并充分振荡试管 |
||
| ③ |
溶液先黄色,滴入KSCN溶液后显红色 |
||
(5)为了提高原料的,老师建议把最后一步所得浅绿色滤液通过蒸发.冷却结晶.过滤.洗涤.自然干燥得到一种带结晶水的硫酸亚铁晶体。
研究小组按老 师的建议完成上面操作步骤,获得晶体后对其进行检测
师的建议完成上面操作步骤,获得晶体后对其进行检测
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。研究小组通过计算测知该晶体的化学式是。