有甲、乙、丙三种物质:
| 分子式 |
C9H8O |
| 部分性质 |
能使Br2/CCl4褪色 |


甲 乙 丙
(1)乙中含有的官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):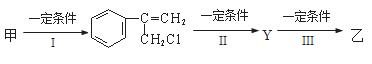
其中反应I的反应类型是_______________,反应II的条件是____________________,反应III的化学方程式为__________________________________(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下: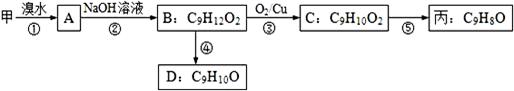
①下列物质不能与B反应的是 (选填序号)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
②丙的结构简式为 。
③D符合下列条件的所有同分异构体 种,任写其中一种能同时满足下列条件的异构体结构简式 。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液发生显色反应 c.能与Br2/CCl4溶液反应
丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) ="=" 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) ="=" 6CO2(g) +6H2O(l)ΔH=-c kJ·mol-1
2H2(g)+O2 (g) ==2H2O(l)ΔH=-d kJ·mol-1(abcd均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量______(填“大于”、“等于”或“小于”)途径II放出的热量
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________
(3)b 与a、c、d的数学关系式是______________
(8分)卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应,其实质是带负电的原子团(例如OH-等阴离子)取代卤代烃中的卤原子。例如:
CH3CH2CH2Br+OH-(或NaOH)→CH3CH2CH2—OH+Br-(或NaBr)
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS反应_____________________。
(2)碘甲烷跟CH3COONa反应_____________________。
(3)由碘甲烷、无水乙醇和金属钠合成甲乙醚(CH3—O—CH2CH3)。_______;。
根据下面的反应路线及所给信息填空。
(一氯环已烷)
(1)A的结构简式是,名称是。
(2)①的反应类型是;②的反应类 型是;
型是;
③的反应类型是;④的反应类型是,
(3)反应④的化学方程式是
请根据官能团的不同对下列有机物进行分类。

(1)芳香烃:;(2)卤代烃:;(3)醇:;(4)酚:;
(5)醛:;(6)酮:;(7)羧酸:;(8)酯:。
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如右图所示:
“立方烷” 的分子式是_________;该立方烷的二氯代物具有同分异构体的数目是_____。
的分子式是_________;该立方烷的二氯代物具有同分异构体的数目是_____。