当前,大量施用氮素化肥是冬小麦获得高产的重要措施之一。
(1)施入土壤的氮素化肥主要以________形式被小麦根部吸收,透气性较好的土壤植物容易吸收氮素化肥,透气性较差的黏质土壤,则根的吸肥力差,这是因为_______________________________________________。
(2)施肥后要及时灌溉,若从麦田流失的水从下图A位置注入一条河流,导致下游水体中藻类和细菌数量发生的变化如下列曲线图所示: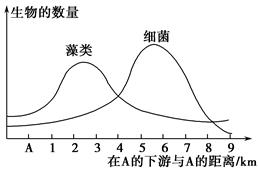
①在A的下游藻类数量增加的原因是____________________________________________________________。
②在3 km以外的河段,细菌数量迅速增加的原因是_____________________________________________________________。
③在下游6 km处的河段发现鱼类大量死亡,原因是______________________________________________________________。
④在距A 2 km处,水中的氧气含量比A处高,原因是______________________________________________________________。
0.1molNH4+中约含有个N,约含有个H.
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,其目的是: _____ ________。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:______________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。
(5)操作Ⅰ包括以下过程:过滤,用(填试剂化学式)溶解,蒸发浓缩,冷却结晶,洗涤获得产品。
(16分)化合物IV为一种重要化工中间体,其合成方法如下: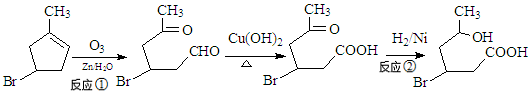
(1)化合物II的化学式为
(2)反应②的反应类型为,1mol化合物III与足量NaOH反应消耗NaOH的物质的量为。
(3)化合物I在NaOH的醇溶液中反应得到化合物X,写出化合物X可能的结构简式
(4)化合物IV在浓硫酸条件下反应生成的六元环化合物V,写出该反应的化学方程式
(5) 异黄樟油素( )发生类似反应①的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
)发生类似反应①的反应,得到乙醛和化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空:(1)A的相对分子质量为。 |
| (2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(2)A的分子式为_____ ___。 |
| (3)另取A 9.0 g,跟足量NaHCO3粉末反应,生成 2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)用结构简式表示A中含有的官能团_____ _、___ ____。 |
(4)A的核磁共振氢谱如下图: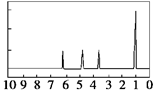 |
(4)A中含有__ ______种氢原子。 |
| (5)综上所述,A的结构简式为______ ____。 |
某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。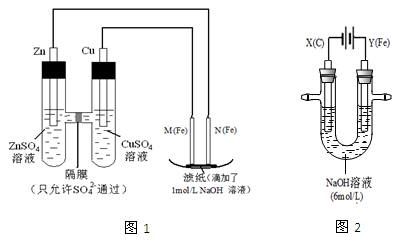
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是(填字母序号)。
| A.铝 | B.石墨 | C.银 | D.铂 |
(2)N极发生反应的电极反应式为。
(3)实验过程中,SO42-(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH(填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH- ="=" FeO42- + 4H2O 和
。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为: K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2该电池正极发生的反应的电极反应式为。