某学生利用以下装置探究喷泉实验。其中A、F分别为硫化氢和氯气的发生装置,C为纯净干燥的氯气与硫化氢反应的装置。

请回答下列问题:
(1)装置F中发生反应的化学方程式 。
(2)装置A中的分液漏斗内液体a可选用 (选填以下选项的代号)
A.盐酸 B.浓硫酸 C.稀硫酸 D.稀硝酸
(3)虚线框内应添加必要的除杂装置,请从上图的“备选装置”中选择合适装置的编号,填入下列空格。B__________、D__________、E__________。
(4)打开K1、K2,将常温压下的H2S、Cl2以体积比1:1充满烧瓶后,烧瓶中发生的反应用化学方程式表示为 ;关闭K1、K2,始终看不到烧瓶内产生“喷泉”现象,理由是: 。
(5)在操作(4)的基础上,引发喷泉操作方法是 。
(每小题2分,共14分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250mL的容量瓶中定容成250mL烧碱溶液; |
| B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂; |
| C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为Mmol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始时的刻度数为V1mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点时消耗酸的体积为V2mL。
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写)
________→________→________→____D____→________;
(2)滴定管读数应注意 ___________________。
(3)操作E中在锥形瓶下垫一张白纸的作用是 _________________。
(4)操作D中液面应调整到 ,尖嘴部分应 。
(5)滴定终点时锥形瓶内溶液的pH约为 ,终点时溶液颜色的变化是 。
(6)若酸式滴定管没有用标准H2SO溶液润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”)(其他操作均正确)。
(7)该烧碱样品的纯度计算式是 。
(10分,每空2分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中 ②__________ |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为____________________
(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。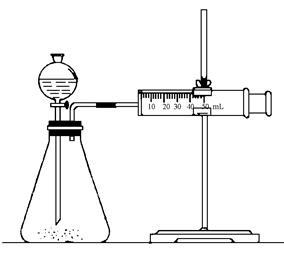
(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是 。
已知某“84消毒液”瓶体部分标签如右所示,该“84消毒液”通常稀释到100倍(体积之比)后使用。请回答下列问题: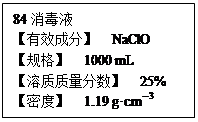
I(1)该“84消毒液”的物质的量浓度约为__________mol·L-1(小数点后保留一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)为__________ mol·L-1。
II某同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。实验步骤如下:
① 将烧杯中的溶液转移至容量瓶中;
② 计算并称量所需的NaClO固体;
③ 向容量瓶中加蒸馏水至液面与刻度线相平;
④ 将NaClO加入100mL 烧杯中,并加适量水溶解;
⑤ 洗涤烧杯和玻璃棒2次,洗涤后溶液转移至容量瓶中;
⑥ 振荡摇匀;
⑦ 颠倒摇匀。
(1)完成上述实验,下图所示的仪器中,还需要添加的玻璃仪器是 。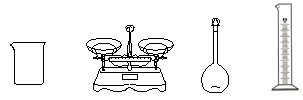
(2)步骤②中计算所需要NaClO的质量为 g;
(3)实验的先后顺序应为 (填写序号);
(4)在步骤①中,为防止溶液溅出,应采取的措施是 ;
(5)在进行步骤③的实验操作时应注意的问题是 ;
(6)配制溶液时,下列实验操作会使配制溶液浓度偏高的是 。
| A.容量瓶内有水,未经过干燥处理 |
| B.进行步骤③操作时,俯视刻度线 |
| C.缺少步骤⑤ |
| D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
E.缺少步骤⑥
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在__________(填“温度较高”或“温度较低”)的情况下进行,在溶液I中加入KOH固体的目的是_________________________。
(2)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________。
(3)洗涤除去K2FeO4晶体表面的杂质,应选择的最佳试剂为(填代号)______________。
a.水 b.KOH溶液 c.饱和K2FeO4溶液 d.异丙醇
(4)目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展。下列物质中可能提高化合物K2FeO4水溶液稳定性的是(填代号)__________。
a.亚硫酸钠b.KOHc.醋酸d.Fe(NO3)2
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,写出该反应的离子方程式:____________________________。
(6)请你设计一个实验,用化学方法区分KClO溶液与KClO3溶液,写出实验简要步骤,观察到的现象和结论____________________________________。
某学生为了测定部分变质的Na2SO3样品的纯度。按图2所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3g。回答下列问题: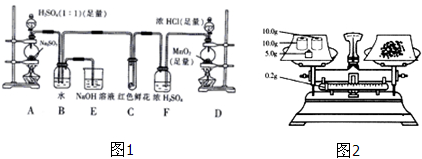
(1)写出A装置(图1)中玻璃仪器的名称:酒精灯、_____________、_____________。
(2)实验开始后,应先点燃____________处酒精灯(填装置字母)。
(3)实验开始后,写出B中反应的离子方程式____________________________。
(4)C中的现象是________________,E装置的作用是________________________。
(5)原样品中Na2SO3的纯度为_____________(精确到0.1%)。按题给装置和操作进行实验,若装置连接和实验操作均无任何问题,该学生测得的Na2SO3的纯度____________(填“偏高”、“偏低”或“无影响”)。