已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。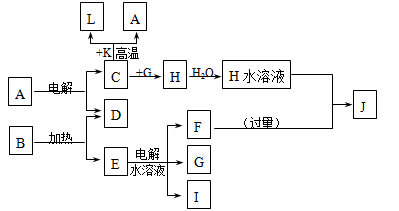
请回答:
(1)工业上制C用A不用H的原因
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)J与H反应的离子方程式为 。
已知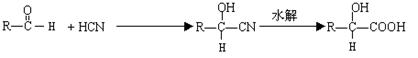
分析下图变化,试回答下列问题: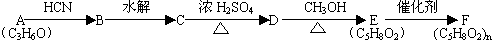
(1)写出有机物的结构简式
AC DE
(2)写出下列有关反应的化学方程式并注明有机反应类型:
D →E;
E →F ;
已知某有机物相对分子质量为58,根据下列条件,回答:
(1)若该有机物只含碳、氢两种元素,则可能的结构简式为________________;
(2)若为含氧衍生物,且分子中只有一个—CH3,则可能的结构简式为________;
用系统命名法命名下列各有机物:
(1) ①(CH3)3CCH2CH(CH2CH3)CH(CH3)2
②CH2=C(C2H5)CH(CH3)CH(CH3)CH2CH3
③CH ≡C—CH(CH3)2
④CH3CH(Br)CH3
(2)下列有机物的命名均有错误,请用系统命名法正确命名
①2—甲基—2—乙基丙烷正确命名:
②2—甲基—4—戊烯正确命名:
下列有机化合物的分子中,有多个官能团:
(1)可以看作醇类的是(填写编号)____________;
(2)可以看作酚类的是________________________;
(3)可以看作羧酸类的是______________________;
(4)可以看作酯类的是________________________。
有甲、丙两种物质:

甲丙
由甲出发合成丙的路线之一如下: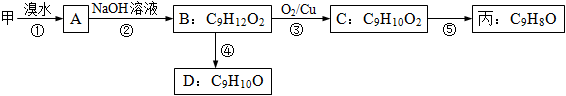
(1)下列物质不能与B反应的是(选填序号)。
a.金属钠b.FeCl3c.碳酸钠溶液d.HBr
(2)C的结构简式为___________;丙的结构简式为。
(3)D符合下列条件的所有同分异构体种,任写其中一种能同时满足下列条件的异构体结构简式。
a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与Br2/CCl4发生加成反应